
연처방액 약 750억원에 달하는 셀트리온제약의 간장약 '고덱스'가 급여재평가에서 급여적정성이 없다는 결론이 나오면서 향후 시장구도에 이목이 쏠리고 있다.
건강보험심사평가원 약제급여평가위원회(이하 약평위)는 7일 2022년 급여적정성 재평가 결과를 공개했다.
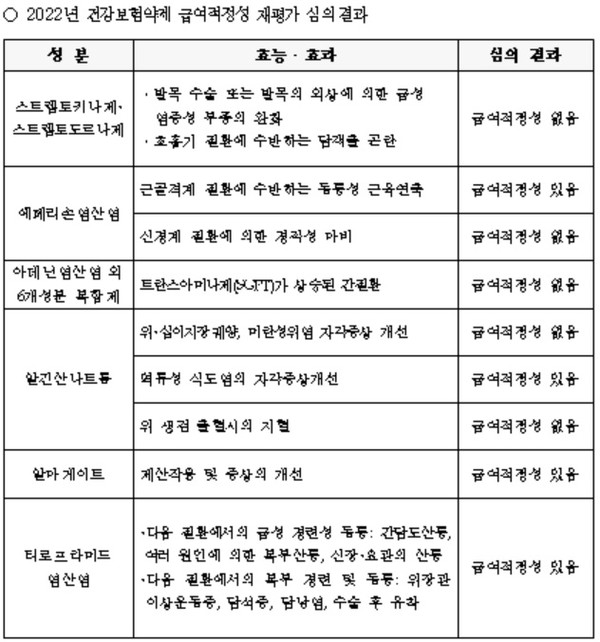
이날 약평위에는 고덱스(성분명 리보플라빈,비페닐디메틸디카르복실레이트,시아노코발라민,아데닌염산염,오로트산카르니틴,피리독신염산염,항독성간장엑스) 뿐만 아니라, 스트렙토키나제·스트렙토도르나제, 알마게이트, 알긴산나트륨, 에페리손, 티로프라마이드 성분도 급여재평가 대상에 올랐다.
약평위는 고덱스가 보유하고 있는 '트란스아미나제(SGPT)가 상승된 간질환' 적응증에 대한 급여적정성이 없다고 결론을 내렸다. 이 성분 제제는 고덱스가 유일하다.
셀트리온제약은 이번 약평위 결과가 최종 평가결과가 아니라는 사실을 강조하며, 자료 보완을 통해 이의 신청을 하겠다는 뜻을 밝혔다.
임상 3상을 통해 판매허가를 획득한 만큼, 유효성 평가 자료를 바탕으로 이의신청 기간동안 심평원, 복지부와 충분히 협의하고 회사 입장을 적극 소명하겠다는 계획이다.
간장약 시장은 고덱스가 리드하고 있는 가운데 대웅제약의 '우루사', 부광약품의 '레가론', 명문제약의 '씨앤유' 등이 경쟁 중이다. 이번 고덱스의 급여 불인정으로 인해 시장구도 변화 가능성이 커졌다.
2021년 유비스트 기준 셀트리온제약의 고덱스는 약 747억원, 대웅제약의 우루사는 493억원, 부광약품의 레가론은 155억원, 명문제약의 씨앤유는 147억원을 기록했다.
레가론의 경우 지난해 11월 임상적 유용성이 미흡하다는 이유로 급여 적정성이 없다는 결론이 내려져 고덱스와 같은 처지가 됐다. 다만 부광약품이 이에 반발해 법적 소송에 나서면서 급여 삭제가 유예된 상태다.
명문제약의 씨앤유는 지난 1월 식품의약품안전처의 임상재평가 대상에 포함돼 유효성을 입증해야 한다. 간장약 시장이 리더들이 급여재평가에 발목이 잡힌 가운데 다른 품목들이 반사이익을 거둘 수 있는 상황에 놓인 것이다.
한편, 이날 같이 심의 대상에 오른 스트렙토키나제·스트렙토도르나제 성분 제제는 보유하고 있는 2개의 적응증 모두 급여적정성이 없다고 결론이 나왔다.
에페리손염산염은 '근골결계 질환에 수반하는 동통성 근육연축' 적응증은 급여적정성을 인정받은 반면, '신경계 질환에 의한 경직성 마비'는 인정받지 못했다.
알긴산타트륨은 '위·십이지장궤양, 미란성위염 자각증상 개선'과 '위 생검 출혈시의 지혈' 적응증은 급여적정성을 인정받지 못했지만, 역류성 식도염의 자각증상개선은 급여적정성을 인정받았다
알마게이트는 제산작용 및 증상의 개선 적응증에 대한 급여적정성을 인정받았다.
티로프라미드염산염도 급성 경련성 동통 등 보유한 모든 적응증에 대한 급여적정성을 인정받았다.
6개성분 관련 제약사는 결과통보 후 30일 이내에 이의신청서를 건강보험심사평가원에 제출할 수 있으며, 제출된 내용은 약제급여평가위원회에서 논의해 최종 결정하게 된다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



