미국이 승인과 가용률 모두에서 EU(유럽연합)와 일본에 비해 신약에 대한 환자 접근성이 더 우수하다는 보고서가 나왔다.
IQVIA는 유럽, 일본, 미국의 환자들이 새로 승인된 약물에 접근할 수 있는 시기와 그 시기가 국가마다 어떻게 다른지를 분석한 보고서(Assessing Availability of New Drugs in Europe, Japan, and the U.S.)를 발간했다.
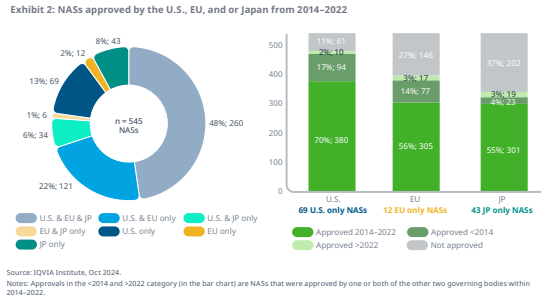
보고서를 보면, 2014~2022년까지 미국, EU, 일본에서 승인된 신약은 총 545개였다.
미국이 가장 많이, EU와 일본보다 평균적으로 더 일찍 신약을 승인했다.
545개 신약 중, 48%(260개)는 미국, EU, 일본 등 세 규제 기관 모두에서 승인됐다.
다른 22%(121개)는 미국과 EU, 6%(34개)는 미국과 일본, 1%(6개)는 EU와 일본에서만 승인됐다.
세 규제 기관 중 한 곳에서만 승인된 제품 중, 13%(69개)는 미국에서만 승인되었고, 2%(12개)는 EU, 8%(43개)는 일본에서만 청신호를 받았다.
EU와 일본 모두 미국만큼 많은 신약을 승인하지 않고 있고, 격차는 매년 확대되고 있다.
2014~2022년, 미국에서 승인된 신약 5개 중 1개(83개/380개)는 EU에서 승인받지 못했고, 약 절반(185개/380개)은 일본에서 승인되지 않았다.
2014년부터 2022년까지 세 규제 기관 모두에서 승인한 신약의 69%(179/260)는 미국에서 먼저 승인되었고, 미국은 평균적으로 EU보다 약 6개월, 일본보다 약 3년 먼저 신약을 승인했다.
또한, 미국에서 승인되었지만 일본에서는 승인되지 않은 신약의 약 2/3가 미국에 본사를 둔 기업들에 의해 개발되었고, 5개 중 1개는 대기업이 개발했다.
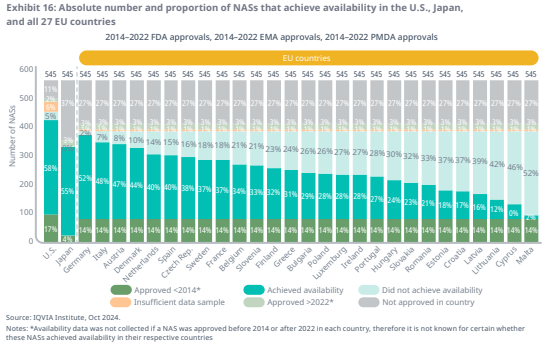
미국은 545개 신약 중 58%(318개)로 가장 높은 가용률을 보였다.
일본(299개), 독일(285개), 이탈리아(261개)는 가용률 측면에서 미국에 가장 근접했지만, 2014-2022년 EMA에서 승인된 신약의 이용은 13~254개로 나머지 EU 국가들은 상당히 뒤처져 있다.
미국, EU 국가 및 일본에서 정책 입안자와 다른 이해관계자는 약품 승인과 가용성 과정에서 발생하는 문제점을 지속적으로 평가하고 강조해야 한다.
일본은 55%(299개)의 가용률로 미국을 바짝 뒤쫓고 있지만, 전체 545개 중 37%(202개)는 일본에서 승인되지 않았다.
일본의 승인 과정, 일본에서 임상시험을 수행해야 할 잠재적 필요성, 또는 승인 후 가격 고려 사항 등은 개발 회사 규모에 관계없이 개발자들이 일본에서 약물 승인 신청을 저해할 수 있다.
미국에서만 승인된 신약은 종양과 신경 치료 분야에 집중되어 있고, 대부분 신생 바이오파마 회사에서 개발한 제품이고, 약 절반이 계열에서 첫 제품이었다.
일본은 신약 개발자가 제품의 승인을 신청하지 않아, 총 승인 신약 수에서 미국과 EU에 뒤처져 있지만, 승인되면 거의 항상 몇 달 이내에 사용할 수 있다.
EU 국가들은 가용률과 가용 시간이 다양하며, 대부분의 EU는 두 지표 모두에서 미국에 뒤처져 있어 이 지역에서 잠재적인 미충족 환자 욕구를 보여주고 있다.
EU와 일본 모두 환자 접근성을 개선하기 위한 새로운 정책 개혁을 제안했지만, 이러한 정책의 효과는 이러한 시장이 의약품 개발자와 환자에게 매력적으로 유지될 수 있도록 계속 추진돼야 한다고 보고서가 강조했다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



