바이넥스에 이어 비보존제약이 제조하는 의약품도 허가·신고 사항과 다르게 제조한 사실이 확인돼 파장이 확산되고 있다.
식품의약품안전처는 비보존제약에서 제조한 의약품 4개 품목과 동 업체에서 수탁 제조하는 의약품 5개 품목에 대해 잠정 제조·판매 중지 명령 및 사용중단을 요청했다고 12일 밝혔다.
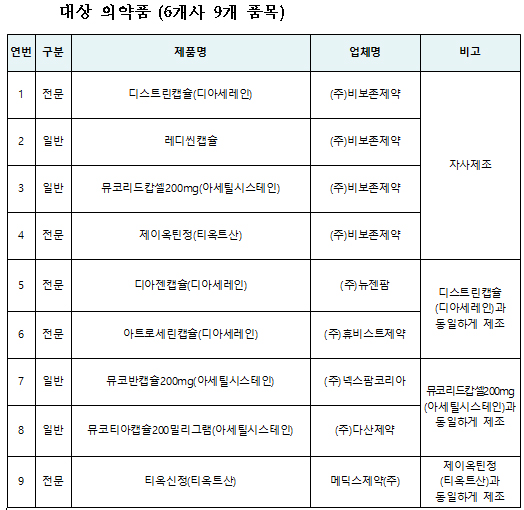
식약처는 정기점검 시 비보존제약에서 제조(수탁 포함)한 디스트린캡슐(디아세레인) 등 4개 품목 관련 해당 제조소에 대한 현장 조사 결과 허가 또는 신고된 사항과 다르게 제조하고 있는 것을 확인했다.
또 해당 품목과 동일한 방법으로 수탁제조하고 있는 다른 의약품 제조업체의 5개 품목을 확인해 사전 예방적 차원에서 해당 9개 품목에 대해 잠정 제조·판매 중지를 명령하고, 전 제조번호에 대해 회수 조치했다.
식약처는 의·약사 등 전문가에게 해당 제품을 다른 대체 의약품으로 전환하고 제품 회수가 적절히 수행될 수 있도록 협조 요청하는 안전성 속보를 의·약사 및 소비자 등에게 배포하는 한편 보건복지부 및 건강보험심사평가원을 통해 병·의원 등에 해당 제품에 대한 처방 제한을 요청했다.
식약처는 전국 위·수탁 제조소 30개소에 대해서도 긴급 특별 점검을 실시할 계획이다.
식약처 관계자는 "점검 결과 등을 고려해 향후 의약품 제조소 전체에 대한 점검으로 확대하는 등 재발방지를 위한 종합적 제도개선 방안도 신속하게 마련해 추진할 것"이라고 밝혔다.
관련기사




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



