
바이오시밀러 글로벌 시장규모가 급격하게 확대될 것으로 전망되고 있다.
이에 따라 업계에서는 R&D 비용은 절감하고, 생산성을 높여 시장에 접근하는 속도를 향상시키는 방안에 대해 관심이 높아지고 있다.
한국보건산업진흥원은 23일 발간한 글로벌보건산업동향 브리프를 통해 ▲R&D 과정의 디지털 전환, ▲업계의 지형변화를 모니터링 후 사전 대처, ▲R&D 운영 모델의 제고라는 3가지 관점의 대안을 제시했다.
보고서에 따르면 바이오시밀러 시장은 향후 상당기간 동안 두 자리 숫자의 성장세를 지속할 것으로 보이며, 2030년에 이르면 시장 규모는 현재의 3배가 넘는 740억 달러에 달할 것으로 전망된다.
특히 2032년까지 최소한 55개의 블록버스터급 첨단 의약품의 독점권이 실효될 전망으로, 이들 첨단 의약품의 최대 시장 규모는 2700억 달러를 넘길 것으로 추정된다.
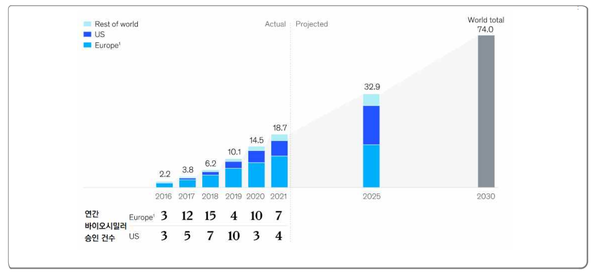
그러나 바이오시밀러 시장의 성장과 동력에 대한 낙관적 전망에도 불구하고 경쟁 격화와 낮은 투자 수익률 등은 기업들의 적극적 참여 동기에 장애요인으로 작용하고 있다.
실제 2018년 베링거인겔하임은 유럽의 바이오시밀러 시장을 포기하고 미국에 집중하겠다는 계획을 발표한 바 있다.
화이자도 2019년 임상시험 단계 이전의 바이오시밀러 프로젝트 5개를 포기한다고 발표했다.
일반적으로 바이오시밀러 의약품의 개발에는 1~3억 달러 정도의 비용이 들어가며, 개발에서 승인에 소요되는 기간 역시 평균 6~9년 정도의 시간이 걸리기 때문이다. 이러한 기간과 비용에는 임상시험이 절반 이상을 차지한다.
바이오시밀러 분야의 임상시험 평균 성공률이 53%에 불과하고, 분야별로 종양학 분야에서는 43%에 달하지만 면역학 분야에서는 8%에 불과할 정도로 분야별 편차가 너무 크다는 문제점도 존재한다.
이를 해결하기 위한 대안으로 보고서는 R&D 과정의 디지털 전환을 우선으로 꼽았다.
바이오시밀러 제조 과정에서 자동화나 로봇 기술을 적용할 수 있는 역량을 갖춘 기업은 일부에 불과한 실정이다.
일부 기업에서 실리콘 모델링 및 예측 기술이나 최적 요소 배합에 디지털 트윈 기술, 실시간 공정 모니터링, 자동화 데이터 수집에 의한 데이터 통합, 지식 산출 및 관리 시스템 등을 적용해 접근성을 높이고 있다.
또한 업계 지형 변화를 지속적으로 모니터링하고 사전에 대처하는 자세가 필요하다.
보고서는 "바이오시밀러 시장이 확대되면서 이에 따른 규제 역시 진화하고 있으며 다양한 규제 기관별로 상이한 접근법을 취하고 있다"면서 "임상 3상 시험에 대한 규제 변화와 교차처방 연구 등은 업계에 커다란 영향을 미칠 것"으로 전망했다.
따라서 보고서는 "바이오시밀러 업계는 개발 단계별로 소요되는 시간을 단축시킬 수 있는 R&D 과정과 차별화된 역량에 집중하게 할 수 있는 아웃소싱, 적절한 인재 배치라는 세 가지 관점에서 R&D 운영 모델 강화가 필요하다“고 제안했다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



