
발암 가능물질인 NDMA(N-니트로소디메틸아민) 검출로 판매중지 조치를 받았던 발사르탄 성분 품목 중 22품목이 추가 해제 조치됐다.
이로써 판매중지 2년 만에 175개 전체 품목의 판매중지가 해제됐으며 급여중지도 동시에 해제됐다.
식품의약품안전처는 28일 0시를 기준으로 NDMA 검출로 제조·판매중지 중인 22품목에 대한 제조·판매중지를 해제했다.
이와함께 건강보험심사평가원의 급여중지도 동일한 일시 기준으로 동시 해제됐다.
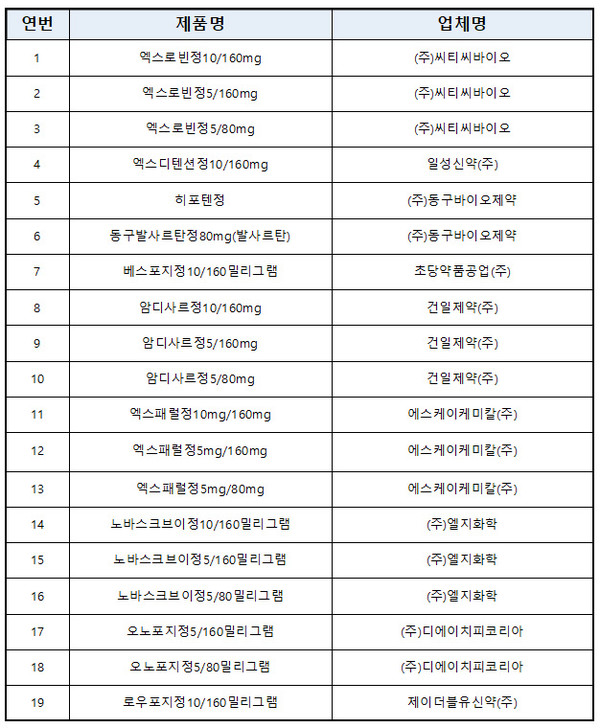
이번 판매중지 조치가 해제된 제품은 씨티씨바이오의 '엑스로빈정10/160mg, 5/160mg, 5/80mg', 일성신약의 '엑스디텐션정10/160mg', 동구바이오제약의 '히포텐정'과 '동구발사르탄정80mg', 초당약품의 '베스포지정10/160mg', 건일제약의 '암디사르정10/160mg, 5/160mg, 5/80mg', 에스케이케미칼의 '엑스패럴정10mg/160mg, 5mg/160mg, 5mg/80mg', 엘지화학의 '노바스크브이정10/160mg, 5/160mg, 5/80mg', 디에이치피코리아의 '오노포지정5/160mg, 5/80mg', 제이더블유신약의 '로우포지정10/160mg, 5/160mg, 5/80mg', 명문제약의 '발사닌정80mg' 등 10개사 22품목이다.
이번 해제 조치는 판매중지 이후 4번째 조치이다. 식약처는 지난해부터 각 시도 보건환경연구원에서 원료약 공정검증 시험을 통과한 제품들에 한해 판매중지 해제 조치를 취해왔다.
지난해 5월 2일 1차로 106품목을 해제했고, 당해 7월 4일 27품목, 8월 14일 20품목을 해제한 바 있다. 이번 22품목에 대한 추가 조치로 175개 전품목이 판매 및 처방이 가능해졌다.
발사르탄 사태는 2018년 7월 중국산 원료 발사르탄에서 NDMA가 검출돼 회수조치되면서 불거졌다.
식약처는 전수조사를 통해 최종 175품목에 대한 판매중지 조치를 취한 바 있다.
이후 라니티딘, 니자티딘, 메트포르민 등에서도 NDMA가 검출되는 등 불순물 파동의 시발점이 됐다. 특히 문제의 원료를 사용하지 않았는데도 판매중지 하는 등 과도한 조치가 지적되기도 했다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



