글로벌 의약품 전주기·규제과학 분야에서 RWD(실사용데이터)/RWE(실사용 증거)의 활용이 중요한 이슈로 떠오르면서, 국내에서도 RWD 활용을 위한 법적·제도적 근거를 명확히 할 필요가 있다는 의견이 나왔다.
최남경 이화여대 융합보건학과 교수는 최근 한국제약바이오협회가 발간한 'KPBMS FOCUS'를 통해 RWD/RWE 외부대조군 활용 동향을 소개했다.
최 교수는 "세계적으로 바이오의약품, 항암제 및 희귀의약품에 대한 신약 개발이 증가하고 있다"며 "희귀의약품의 경우 임상 2-3상에서 충분한 표본확보나 비교군 설정이 어려워 무작위배정 임상시험(RCT)이 불가능한 경우가 많아, 대조군 없이 약을 테스트 하는 단일군 임상시험을 제출하는 경우가 빈번한데 이때 RWD가 외부대조군으로 활용될 수 있다"고 밝혔다.
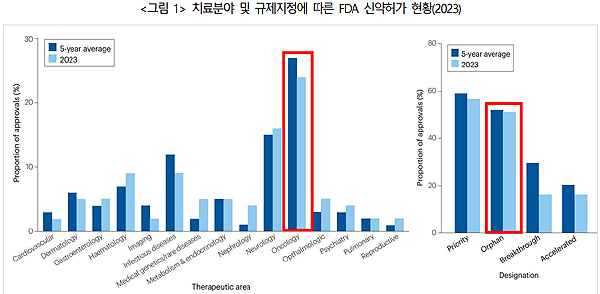
실제로 2023년 미국 식품의약국(FDA)에서 허가된 55개 신약 중 30.9%가 바이오의약품, 24%가 항암제, 52%가 희귀의약품에 해당한다. 최근 5년간 허가된 의약품의 평균 50% 이상이 희귀의약품에 해당할 정도로 희귀의약품의 점유율은 점점 증가하고 있는 추세다.
RWD 기반 외부대조군은 외부의 비무작위 데이터베이스에서 파생된 환자를 의미하며, 주로 신약 허가 또는 적응증 확대 시 단일군 임상시험의 환자와 비교돼 RCT가 실현 가능하지 않거나 윤리적이지 않은 경우에 비교성을 제공하기 위해 활용된다.
최 교수는 "의약품 허가를 위해 캐나다, 프랑스, 영국, 독일, 호주 5개국을 포함한 규제기관 및 의료기술평가(HTA) 기관에 제출된 외부대조군 활용 사례를 확인했다"며 "단일군 임상시험 기반의 433건의 제출물 중 226건(52.2%)가 외부대조군을 포함했고, 외부대조군의 출처는 이전 임상시험 기반 24%, RWD 기반 20%, 이전 임상시험과 RWD 동시사용 기반 8.1% 순이었다"고 말했다.
글로벌 RWD 외부대조군 활용 사례
항암제 시판 허가를 위해 EMA에 제출된 문서와 비항암제 허가를 위해 FDA에 제출된 문서에도 외부대조군이 포함된 사례가 확인됐다.
European Public Assessment Reports(EPARs)에 따르면, 2016년부터 2021년까지의 항암제 최초 허가 신청서 103개 중 18개의 항암제가 허가 신청서에 외부대조군을 포함했으며, 18개의 항암제에서 총 24개의 외부대조군이 활용됐다. 활용된 24개 외부대조군 중 9개가 RWD를 활용한 것으로 나타났다.
또 2000년부터 2019년까지 FDA의 비종양성 의약품 허가 시 외부대조군이 활용된 사례를 보면, 45개 제품 중 80%에 해당하는 36개 제품이 희귀질환 의약품에 해당했다. 45개 제품의 외부대조군은 후향적 RWD가 20개(44%)로 가장 많았다.
최 교수는 "RWD 외부대조군은 RCT를 수행할 수 없는 신약의 단일군 임상시험 비교군으로서 유용하게 활용될 수 있지만, 외부대조군과 임상시험군의 이질성 및 연구방법에 대한 우려사항은 규제기관의 RWD 수용을 방해하는 주요 쟁점"이라면서 "자료 간 이질성, 상호운용성 결여를 해결하기 위한 데이터 품질관리, 표준화, 데이터 연계 등에 대한 고려가 필요하다"고 지적했다.
글로벌 시장에서 RWD 활용이 늘어나는 만큼, 국내 의약품 규제 의사결정에서 보다 적극적인 RWD 활용의 필요성도 제기됐다.
최 교수는 "국외에서는 시판 후 안전성 평가 연구는 물론 신약허가, 적응증 확대 및 라벨변경에도 RWD가 활발히 활용되며 수용도도 높은 편"이라면서 "그러나 국내는 시판 후 연구의 방법으로 여전히 사용성적조사가 주를 이루고 있으며, 법적·제도적 근거가 모호해 실제 RWD 연구가 수행되기에는 법적인 실효성이 부족한 실정"이라고 지적했다.
또한 현재까지 발행된 RWD 가이드라인도 시판 후 연구에 집중돼 있어, 외부대조군을 포함한 의약품 전주기에서 RWD/RWE가 활용될 수 있도록 다양한 가이드라인 개발 논의가 필요하다는 것.
다만 국내는 신약, 희귀의약품 등에 대해 2025년 2월부터 재심사제도와 위해성관리계획 제도가 일원화될 예정이어서, 능동적인 약물감시로 RWD가 활용될 수 있다는 판단이다.
최남경 교수는 "전 세계적으로 희귀의약품은 정부차원에서 개발을 장려해 시장규모가 급속도로 성장하고 있고, RWD 외부대조군의 활용은 의약품 개발과 규제과학의 새로운 패러다임으로 자리 잡아가고 있다"며 "신약의 신속한 허가를 위한 규제적 의사결정에서 중요한 RWE로 작용할 수 있다"고 강조했다.
그는 "그러나 외부대조군의 성공적인 활용을 위해서는 몇 가지 필수적인 요건들이 충족돼야 한다. 데이터의 신뢰성과 연구설계의 견고함, 그리고 규제기관과의 긴밀한 의사소통이 필수적"이라며 "따라서 법적·제도적 기반을 강화하고, 데이터의 품질을 보장하는 체계 마련과 전문가 교육 및 역량 강화를 통해 RWD와 외부대조군은 보다 폭넓게 활용될 수 있을 것"이라고 덧붙였다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



