의약품 공급중단 보고시점이 기존 60일 전에서 180일 전으로 앞당겨진 가운데, 3개월 이상 생산·수입이 일시적으로 정지돼 실제 시장에 공급이 1개월 이상 정지되는 경우도 공급부족 보고가 의무화된다.
다만 보고대상 지정 전 생산·수입이 일시정지 또는 감소한 경우 등은 보고대상에서 제외된다.
식품의약품안전처(처장 오유경)는 완제의약품 공급부족에 대한 예측성을 높이기 위해 제약사 보고 기준 등을 규정하는 '생산·수입·공급 중단 보고대상 의약품 보고 규정'(식약처 고시)을 5월 26일 개정했다고 밝혔다.
이번 고시 개정은 완제의약품의 공급중단 보고 시점을 기존 60일 전에서 180일 전으로 앞당기고, 공급부족이 예상되는 경우 의무적으로 보고하도록 하는 등의 내용을 포함한 '의약품 등의 안전에 관한 규칙'(총리령)이 지난달 5일 개정됨에 따라 총리령에서 위임한 사항 등을 반영했다.
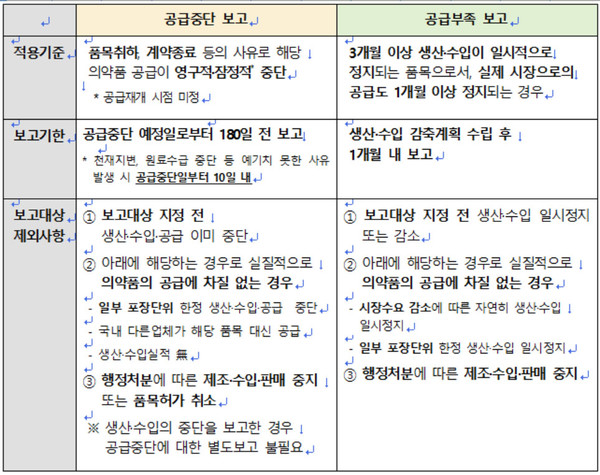
이에 따른 고시의 주요 개정내용은 ▲공급부족 의무보고 대상 기준 마련 ▲공급부족 보고의 예외 사유 마련 ▲공급중단 보고시점 변경(60일 전→180일 전)에 따른 세부절차 정비 등이다.
개정안은 3개월 이상 생산·수입이 일시적으로 정지돼 실제 시장으로의 공급이 1개월 이상 정지되는 품목에 대해 공급부족 의무보고를 하도록 기준을 신설하고, 이를 계획이 수립된 날로부터 1개월 내 보고하도록 했다.
또한 시장수요 감소에 따른 생산·수입 정지 등 실질적으로 의약품 공급에 차질이 없는 경우와 일부 포장단위 한정 생산·수입 일시정지로 의약품 공급에 차질이 없는 경우를 공급부족 보고 예외 사유로 마련하는 등이 포함된다.
행정처분에 따른 제조·수입·판매 중지에 따른 일시정지도 보고대상에서 제외된다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



