세포 및 유전자 치료(CGT) 분야에서 지배적인 암 치료제로 부상한, CAR-T(Chimeric antigen receptor T) 세포 치료 분야를 혈액암이 지배하고 있다.
B세포 급성 림프구성 백혈병 등 혈액암 치료 패러다임을 변화시킬 수 있는 이들로 BMS, 노바티스 등 업계 리더들이 이런 변혁의 최전선에 있다.
데이터 및 분석 회사인 글로벌데이터의 보고서를 보면, 혈액암은 파이프라인에서 전체 CAR-T의 절반 이상과 상위 10개 CAR-T 적응증 중 9개를 차지하고 있다.
CAR-T 치료제는 종양 CGT 분야에서 승인의 절반 이상을 차지하는, 선도적인 유형의 T세포 면역치료제이다.
이런 치료 방식은 CAR을 발현하도록 자가 또는 동종 T세포를 유전적으로 조작함으로 암세포를 적극적으로 인식하고 파괴하는 것과 관련이 있다.
현재 13개의 CAR-T 치료제가 승인을 받았다.
이 중에는 2017년 FDA 승인을 받은 길리어드 사이언스의 예스카타(Yescarta, axicabtagene ciloleucel)와 지난 1월 인도에서 승인을 받은 이뮤넬 테라퓨틱스의 카테미(Qartemi, varnimcabtagene autoleucel) 등이 있다.
다른 모든 승인된 CAR-T와 마찬가지로, 두 약물도 혈액암에 적응증을 가지고 있다.
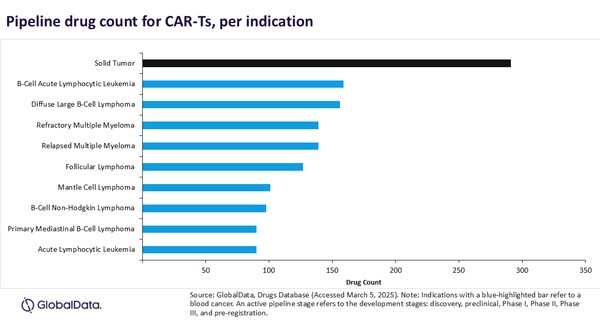
CAR-T 파이프라인 1729개 중 903개(52%)가 혈액암을 표적으로 개발되고 있는 등, CAR-T 제품에서 혈액암의 지배력은 파이프라인 제품으로 확대되고 있다.
CAR-T에 대한 상위 10개 적응증 중 9개가 혈액암이다.
림프종이 5개 적응증으로 최다이고, 백혈병과 다발성 골수종이 각각 2개이다.
고형 종양은 최다 적응증이지만, CAR-T는 이 분야에서 상업적 또는 임상적 성공에 한계가 있다.
159개 후보 제품으로 구성된 B세포 급성 림프구성 백혈병은 파이프라인 CAR-T에 대한 선두 혈액암이다.
이는 어린이에게 가장 흔한 유형의 암이고 재발이나 표준 치료에 대한 내성으로 인해 치료가 어렵다.
상당수의 환자에서 완전 관해를 입증한, 2017년 FDA 승인을 받은 노바티스의 킴리아(Kymriah, tisagenlecleucel)와 같은 주요 약물 등, CAR-T는 이런 암 유형에 대한 치료에 큰 변화를 가져왔다.
B세포 급성 림프구성 백혈병에 대해 FDA 승인을 받은 5개 제품 중 3개가 CAR-T로, 이 적응증에서 중요성을 빠르게 발전시켰다.
파이프라인 CAR-T 수 기준 상위 2개 혈액암 외에, B세포 급성 림프구성 백혈병과 미만성 대 B세포 림프종은 첫 승인을 기다리는 제품에 대한 가장 진보된 파이프라인 CAR-T를 특징으로 한다.
중국에서, CPB(Chongqing Precision Biotech)의 pCAR-19B가 B세포 급성 림프구성 백혈병에 대해 등록 전에 있고, 한국 식품의약품안전처는 미만성 대 B세포 림프종에 대한 큐로셀의 안발카바타진 오토루클(anbalcabtagene autoleucel)를 검토 중에 있다.
BMS는 다발성 골수종 치료제 아벡마(Abecma, idecabtagene vicleucel)와 다양한 림프종과 골수종에 승인된 브레얀지(Breyanzi, lisocabtagene maraleucel) 등, 2개 제품의 마케팅으로 현재 CAR-T 분야에서 선두주자이다.
혈액암에 대한 첫 승인을 위해 14개의 CAR-T가 개발 중에 있다.
CAR-T 제품을 개발 중인 다른 선도적인 기업으로는 중국의 SGIMI(Shenzhen Geno-Immune Medical Institute)로, 2상 임상 8개 등 14개의 CAR-T를 활발히 연구하고 있다.
글로벌데이터는 높은 수의 파이프라인 CAR-T를 고려할 때 향후 몇 년 동안 B세포 급성 림프구성 백혈병과 미만성 대 B세포 림프종과 같은 혈액암에 대한 승인이 더 많이 이루어질 것으로 예상했다.
또한, 기업들이 CAR-T 파이프라인을 계속 발전시킴에 따라, CAR-T가 혈액암 치료에 미치는 영향력이 계속 커질 것으로 전망했다.
한편, 컨설팅 업체인 FBI(fortunebusinessinsights)에 따르면, 글로벌 CAR-T 세포 치료제 시장은 2023년 43.8억 달러로 평가됐고, 2024년 63.7억 달러에서 2032년 163.5억 달러 규모로 연평균 12.5% 성장할 전망이다.
2023년 3월 기준, CAR-T 세포 치료제에 대해 443개 파이프라인 후보가 미국 임상시험 등록기관인 ClinicalTrials.gov의 리스트에 등재됐다.
반면, 2012년은 CAR-T 세포 치료제를 평가하는 임상시험은 12개에 불과했다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



