글로벌 톱셀링 약품의 바이오시밀러가 아달리무맙(adalimumab) 시장의 새로운 시대를 예고하고 있어, 휴미라(Humira)의 지배는 마침내 미국에서 끝나가고 있다.
2023년은, 애브비가 특허소송과 역지불 합의를 통해 바이오시밀러 기업들의 출시일을 연기할 수 있었던, 미국에서 휴미라 바이오시밀러 시장의 공식적인 시작을 알리는 신호탄이 될 수 있다.
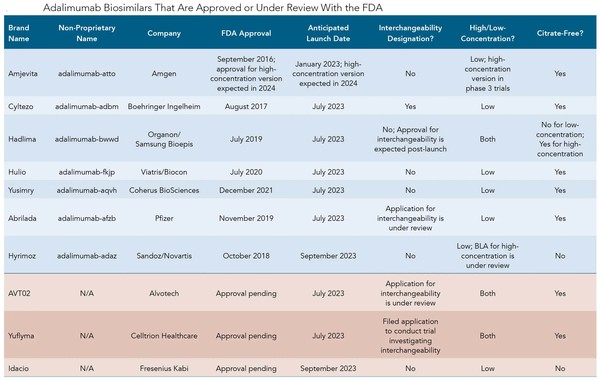
현재, 7개 FDA 승인 바이오시밀러가 미국 시장에 진출을 기다리고 있다.
이들 제품 모두는 유럽연합(EU)에서 마케팅되고, 캐나다와 영국에서도 대부분 이용할 수 있다.
내년 1월에, 미국 시장에 첫 발을 디딜 것으로 예상되는 휴미라 바이오시밀러는 암젠의 암제비타(Amjevita, adalimumab-atto)이다. 암제비타는 2016년 9월 미국 FDA 승인을 받은 첫 휴미라 바이오시밀러 버전이다.
암제비타에 이어, 2023년 7월 초에 실테조(Cyltezo), 하들리마(Hadlima), 훌리오(Hulio), 유심리(Yusimry) 등 4개의 다른 휴미라 바이오시밀러들이 론칭될 예정이다.
2017년 8월 승인된, 실테조는 베링거인겔하임의 바이오시밀러이며, 유심리는 코헤루스 바이오사이언스가2021년 12월에 청신호를 받았다.
하들리마는 삼성바이오에피스가 개발하고 머크(MSD)에서 분사한 오가논이 마케팅하는 반면, 훌리오는 후지필름 교와기린이 개발하고 화이자업존과 마일란의 벤처인 비아트리스가 판매를 맡는다.
훌리오는 2020년 7월에 승인됐다.
하들리마의 저농도 제형은 2019년 7월, 고농도 제형은 2022년 8월에 허가됐다.
2023년 9월에는 하이리모즈(Hyrimoz)가 출시될 예정이다. 이 약품은 노바티스의 제네릭 자회사 산도스가 2018년 10월 승인을 받았다.
승인 대기
현재, 3개의 바이오시밀러가 FDA 승인을 기다리고 있다.
또한, FDA는 이미 저농도 제형으로 승인된 1개 바이오시밀러의 고농도 버전에 대해 BLA(biologics license applications)를 검토하고 있다.
알보텍의 휴미라 바이오시밀러 후보인 AVT02는 2022년 말까지 승인과 2023년 7월 출시 예정이다.
AVT02는 FDA의 BLA와 대체조제 가능성을 동시에 고려하고 있다는 점에서 독특하다.
하지만, 최근 FDA는 제조 문제로 AVT02의 승인을 연기했다.
올해 말까지 승인이 예상되는, 셀트리온 헬스케어의 유플리마도 2023년 7월 출시할 것으로 예측된다.
프레지니우스 카비의 이다시오(Idacio)는 올해 4분기 승인이 예상되고, 내년 9월에 출시할 계획이다.
하이리모즈 고농도(100mg/ml) 버전은 승인 검토에 있고, 암제비타의 고농도 제형은 3상 임상에서 평가 중에 있다.
농도와 대체조제 가능성
휴미라 바이오시밀러 사이에서 주요 특징 중 하나는 제품의 농도다.
고농도 제형은 저농도 제형에 비해 환자가 더 적은 용량의 아달리무맙을 받게 된다.
현재 FDA가 승인한 아달리무맙의 고농도 제형은 휴미라와 하들리마가 유일하다.
보험관리업체인 Vizient에 따르면, 미국 시장에서 휴미라의 고농도와 저농도 버전을 이용할 수 있지만, 처방의 80% 이상이 고농도 제형이다.
FDA에서 승인 검토 중인 휴미라 바이오시밀러 중, AVT02와 유플리마는 모두 고농도와 저농도 제형이 있다.
이다시오는 저농도 제형에 대해서만 검토 중에 있다.
고려해야 할 다른 중요한 요소는 제품에 구연산염(citrate)의 유무이다.
구연산염이 없는 제형은 아달리무맙 투여 동안 환자가 주사 부위의 통증을 덜 경험하고 더 작은 주삿바늘을 사용할 수 있게 한다.
FDA에서 승인됐거나 검토 중인 모든 아달리무맙 제품 중, 하이리모즈, 이다시오와 하들리마의 저농도 버전만이 시장에 진입할 때 구연산염이 없는 옵션이 없을 수 있다.
하들리마 고농도 제형은 구연산염 없이 출시될 수 있다.
대체조제는 약사가 환자에게 바이오시밀러를 제공하기 위해 승인을 받는 시간을 단축해 환자가 바이오시밀러에 보다 쉽게 접근할 수 있도록 한다.
바이오시밀러 제조업체는 대체조제 지정을 받기 위해, 추가 임상 시험을 위해 추가 시간과 비용을 지출해야 한다.
환자가 오리지널 제품에서 바이오시밀러로 최소 3회 이상 전환하는 동안, 안전하고 임상 결과에 영향을 미치지 않는다는 것을 입증해야 한다.
대체조제 가능한 바이오시밀러는 지금까지 3개만 승인됐다.
이는 셈글리(Semglee, insulin glargine), 시메릴(Cimerli, ranibizumab), 실테조(Cyltezo, adalimumab) 등이다.
현재, 미국 시장에서 셈글리만 마케팅되고 있다.
시메릴은 오는 10월에 론칭될 예정이다.
하들리마, 아브릴라다(Abrilada), AVT02를 개발한 회사들은 바이오시밀러에 대한 대체조제 가능성을 추구할 것이라고 언급했다.
대체조제 지정을 둘러싼 큰 우려는 대체 가능한 바이오시밀러가 대체조제 지정을 받지 않은 바이오시밀러보다 우수하다고 간주될 수 있다는 것이다.
대체 조제 가능한 바이오시밀러가 같은 오리지널 약품에 대한 다른 바이오시밀러보다 더 우수하거나 안전하지 않다.
지정은 전환연구가 실시돼 환자에게 보다 쉽게 공급될 수 있다는 의미일 뿐이다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



