류마티스성 관절염 치료 등에 사용되는 JAK억제제 3개 성분이 심장마비 등 중증 심장질환 발생 위험을 증가시킬 수 있는 것으로 나타났다.
식품의약품안전처는 ‘토파시티닙’, ‘바리시티닙’, ‘유파다시티닙’ 3개 성분 제제에 대한 ‘의약품 안전성 서한’을 배포했다고 3일 밝혔다.
이번 안전성 서한은 지난 1일 미국 식품의약품청(FDA)이 토파시티닙 등 3개 성분 제제에 대해 심장마비 등 중증 심질환, 암, 혈전 및 사망 위험 증가 내용을 박스 경고에 추가할 예정이라는 서한을 발표한데 따른 것이다.
미국 FDA는 토파시티닙 성분 제제의 안전성 관련 대규모 무작위 임상시험을 검토한 결과, 해당 제제 복용 시 심장마비나 뇌졸중, 암, 혈전, 사망 등의 위험이 증가함을 확인했다.
토파시티닙과 동일한 기전을 가진 바리시티닙, 유파다시티닙 성분 제제의 경우도 유사한 위험을 수반할 것으로 간주했다.
이에 토파시티닙, 바리시티닙, 유파다시티닙 등 3개 성분 제제에 대해 ▲박스 경고에 중증 심질환, 암, 혈전, 사망의 위험을 추가하고, ▲해당 제제 복용 개시 또는 지속 시 환자의 유익성·위해성을 고려하도록 권고할 예정이며, ▲TNF 억제제에 반응하지 않거나 내약성이 없는 특정 환자에게만 사용하도록 사용을 제한할 예정이다.
이와 관련해 식약처는 의약전문가 및 환자에게 관련 정보를 제공하기 위해 안전성 서한을 배포하고, 추가로 국내‧외 허가현황 및 사용실태 등을 종합적으로 검토해 필요 시 허가사항 변경 등을 진행하기로 했다.
토파시티닙 등 3개 성분 제제는 야뉴스키나제(JAK) 억제제로, 관절염 또는 궤양성 대장염 등 만성 염증성 질환의 치료에 사용되는 약물이다.
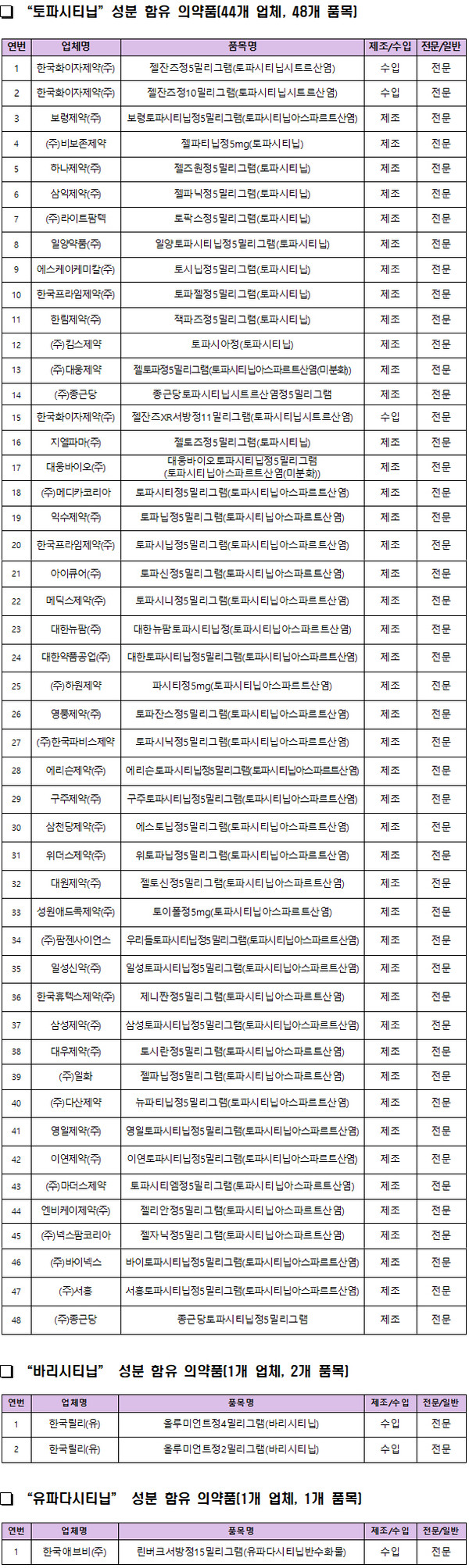
국내 토파시티닙 성분은 한국화이자제약의 '젤잔즈' 등 44개사 48개 품목, 바리시티닙은 한국릴리 '올루미언트' 1개사 2개 품목, 유파다시티닙은 한국애비브의 '린버크서방정' 1개사 1개 품목 등 총 46개사 51개 품목이 허가돼 있다.
식약처는 해당 의약품에 대한 우리나라, 유럽, 미국 등 국내·외 허가현황, 사용실태, 조치현황 등을 검토하고 전문가 자문 등을 종합해 환자 안전을 최우선으로 필요한 안전조치를 신속히 취할 계획이다.
아울러 국내 병·의원에서는 해당 성분을 환자에게 투여 시 이번 안전 정보를 반드시 확인할 것을 강조했다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



