한미약품의 호중구 감소증 치료제 '롤론티스(성분명 에플라페그라스팀)'가 국내 허가를 받았다.
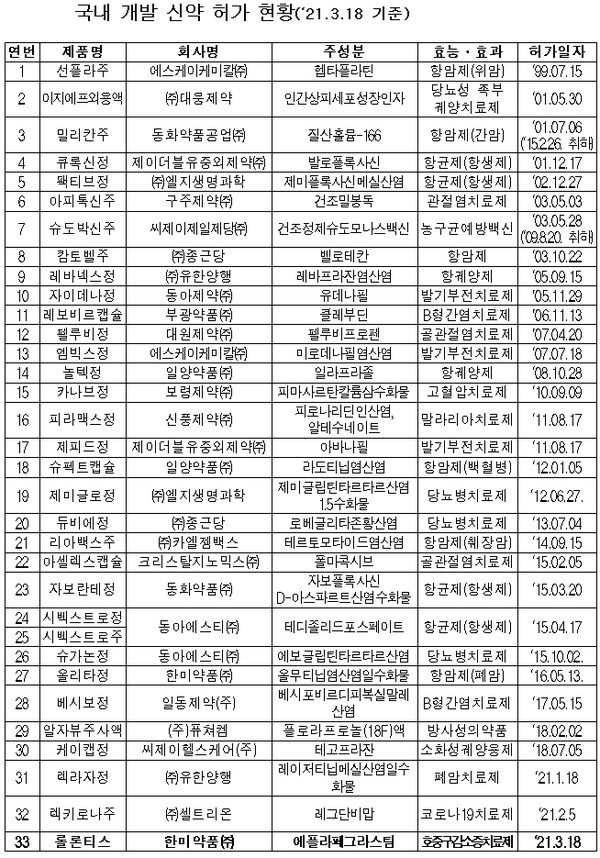
식품의약품안전처는 18일 한미약품의 호중구 감소증 치료제 ‘롤론티스프리필드시린지주’를 국내 33번째 개발 신약으로 허가했다.
호중구 감소증은 백혈구 중 40~70% 차지하는 호중구가 비정상적으로 감소해 감염에 취약해지는 증상을 말한다.
롤론티스는 항암화학요법으로 나타날 수 있는 호중구 감소증의 치료에 사용되며, 과립구집락자극인자(G-CSF) 수용체에 결합해 호중구 생성을 촉진하는 기전을 갖고 있다.
고형암 및 악성 림프종에 대한 세포독성 화학요법을 투여 받는 환자의 중증 호중구 감소증의 기간 감소에 대해 적응증을 확보했다.
이 약은 재조합기술을 이용해 제조한 사람의 G-CSF 유사체에 특정 단백질을 연결해 약효지속성을 증가시킨다.
롤론티스는 한미약품이 개발해 2012년 미국 제약기업 스펙트럼에 라이선스 아웃한 바이오신약으로, 바이오의약품의 약효와 투약 주기를 획기적으로 늘려주는 한미약품 독자 플랫폼 기술 ‘랩스커버리’가 적용됐다.
한미약품은 이 플랫폼 기술로 구현된 펩타이드 구조 자체의 신규성, 기존 약물 대비 적은 용량으로도 투여 횟수를 줄인 기술의 진보성을 토대로 식약처에 허가를 신청했다.
이번 식약처 시판허가 신청은 파트너사인 스펙트럼이 주도한 2건의 글로벌 임상 3상(ADVANCE, RECOVER) 데이터를 토대로 제출됐다.
골수억제성 항암화학요법으로 호중구감소증이 발생한 초기 유방암 환자 643명을 대상으로 진행된 두 임상에서 롤론티스의 안전성과 약효가 확인됐다. 롤론티스는 총 네 번의 치료 사이클 동안 경쟁약물 대비 DSN(중증 호중구 감소증 발현기간)의 비열등성 및 우수한 상대적 위험 감소율 등이 입증됐다.
올해 상반기 국내 출시 예정인 한미약품은 국내 업체가 개발해 시판한 바이오신약들 중 상업적 성공 가능성이 가장 큰 제품이 될 것으로 전망하고 있다.
한편 롤론티스는 최근 미국 식품의약국(FDA)이 잠정 연기됐던 제조 시설에 대한 실사를 재개해 미국 허가에도 속도를 내고 있다.
FDA는 지난 16일(한국시각) 코로나19 팬데믹에 따른 미국 공무원 여행 제한 조치에 따라 잠정 연기됐던 한미약품의 평택 바이오플랜트에 대한 '승인 전 실사'를 5월 중 진행하겠다고 통보한 바 있다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



