
소아의료가 필수의료 중 하나로 대두되고 있는 가운데 소아청소년 복합 만성질환자수가 증가하는 등 질환의 중증도가 높아지고 있는 것으로 나타났다.
이에 따라 소아 질환을 대상으로 하는 연구개발을 통해 소아 대상 임상시험 활성화 및 소아 대상 의약품·의료기기 사용의 임상적· 과학적 근거를 확보하는 것이 필요하다는 의견이 나왔다.
최근 보건산업진흥원이 발표한 소아질환 분야 주요 동향 브리프는 "소아는 의료 영역에서 소외된 분야로 정부에서도 응급 및 분만·소아 등 적정 공급이 어려운 필수의료 확충을 위한 정책 등을 마련하고 있다"고 강조했다.
소아질환은 성장하면서 만성질환으로 이어질 확률이 높은데, 예방과 치료제 적시에 적절히 행해지지 않을 경우 개인 및 사회경제적으로 상당한 손실을 야기한다.
또한 소아 치료 시 소아 대상 안전성과 유효성이 입증된 의약품을 사용해야 하지만, 대부분 의약품은 성인을 기준으로 허가 받기 때문에 소아 대상 의약품이 부족한 상황이다.
실제 소아청소년 치료 시 소아 대상 의약품 부족으로 오프라벨 처방이 많이 사용되고 있으며, 그에 따른 부작용 등 위험에 노출되어 있다.
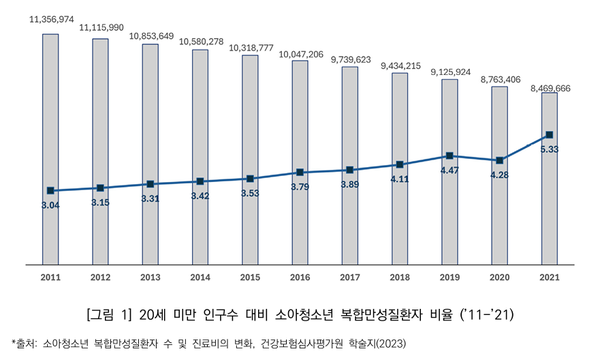
심사평가원 자료에 따르면 소아청소년 복합만성질환자수는 2011년 34.5만 명에서 2021년 45.1만 명으로 10.6만 명으로 증가했다.
미국의 경우는 소아 의약품 개발 및 소아 임상시험의 어려움과 허가범위 외 사용에 대한 문제점을 인지하고, 소아 대상 의약품 개발 인센티브, 소아 임상시험 의무화 등 소아 관련 법령을 제정해 시행하고 있다.
EU역시 1997년 미국에 이어 유럽의 소아질환 의약품 검토를 위한 전문가위원회를 유럽의약품청(EMA)에 설치하고 인센티브 도입 필요성에 관한 검토를 시작해 Paediatric Regulation(2007)를 시행하고 있다.
일본은 2023년 아동가정청을 설립해 아동가정과학연구를 통해 정책입안 등을 위한 기초자료와 과학적 근거 확보를 위한 연구, 정책의 추진과 평가에 관한 연구, 의료 외 분야의 기술개발에 관한 연구를 추진중이다.
또한 2024년 1월 희귀의약품 지정 기준 개정을 발표해 세부 내용으로 성인용 의약품 개발 중 '소아용 의약품 개발 프로그램 계획' 제출을 기분원칙으로 제시했다.
한편 국내는 소아에 대한 임상시험 수행 및 소아 사용 의약품 개발을 의무화하고 있는 법이나 제도는 없지만, 식품의약품안전처에서 소아 의약품 개발 촉진을 위한 안내서 및 가이드라인이 발표되고 있다.
또 소아 관련 종합적인 연구개발 정책 및 연구개발 사업은 없는 상황이며, 소아 관련 정부투자 연구개발비는 2019년 이후 증가추세를 보였지만 4년간 전체 R&D 대비 0.07~0.1%로 여전히 미흡한 수치를 기록했다.
특히 소아 R&D는 대부분 기초연구 사업 내 일부 과제로 지원되고 있으며, 소아를 대상으로 특정해 지원되는 사업은 없는 것으로 나타났다.
임상시험의 경우 국내 소아 임상시험 지원 사업 및 소아 임상 네트워크는 없으며, 식약처 임상시험계획 승인 현황을 볼 때 국내 소아임상시험은 내우 저조한 상황이다.
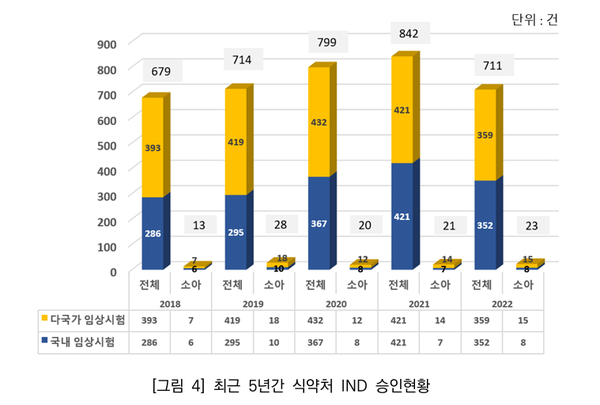
실제 최근 5년간 식약처 임상시험계획 승인현황을 분석한 결과, 전체 IND 승인 건수는 3745건이었으며, 소아대상 IND 승인 건수는 105건으로 전체 승인 건수 대비 2.8%밖에 미치지 못했다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



