
글로벌 제약산업의 중심이 합성의약품에서 바이오의약품으로 이동 중인 가운데 혁신신약의 성장이 두드러지는 것으로 나타났다.
바이오의약품이 글로벌 제약산업을 견인하면서 희귀질환 등에서 혁신신약 개발 요구가 증대함에 따라 관련 시장이 활성화되고 있는 것이다.
생물학연구정보센터는 최근 미래전략연구소 '혁신신약 개발 활성화' 보고서를 소개하며 "美 FDA의 혁신의약품 지정 프로그램에 대응되는 韓 식품의약품안전처의 글로벌 혁신제품 신속심사지원체계(GIFT)를 통한 신약 심사기간 단축 및 의약품의 빠른 상용화가 기대된다"고 밝혔다.
생명공학 기술 발전과 코로나19 팬데믹으로 인해 고부가가치 바이오의약품 시장이 확대됨에 따라 바이오의약품이 전체 의약품 시장의 성장을 주도하고 있다.
전체의약품 대비 바이오의약품 비중은 지속적으로 증가해 2026년에는 37%까지 증가할 것으로 전망된다.
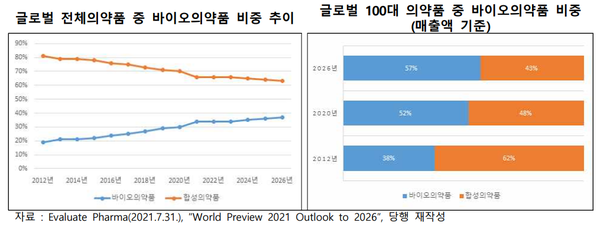
보고서는 글로벌 매출 상위 100대 의약품 중 바이오의약품 매출 비중은 2020년 기준 52%이며, 2026년에는 57%를 차지할 것으로 예상했다.
시장 내에서도 희귀질환, 면역질환, 피부질환 분야에서 혁신 신약 개발에 대한 요구가 증가하면서 관련 연구가 활발하다.
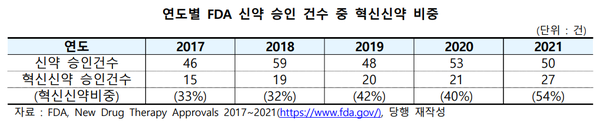
지난해 FDA에서 승인된 신약 50건 중 혁신신약 비중은 54%로 최근 5년간 증가 추세를 보였으며, 향후 혁신신약의 시장 출시는 더욱 활발해질 것으로 전망된다.
특히 FDA가 혁신신약으로 지정한 의약품의 경우 우선심사 지정검토 대상으로 선정되어 심사기간을 획기적으로 줄였다.
FDA의 신속심사 프로그램(Expedited Programs)에는 ▲패스트트랙(FastTrack), ▲혁신의약품 지정(Breakthrough Therapy Designation), ▲우선심사(Priority Review), ▲가속승인(Accelerated Approval)이 있다.
신속심사 프로그램 간 상관관계 분석 결과 혁신의약품으로 지정된 약물은 대부분 우선심사 대상으로 지정되어 신청에서 승인까지 평균 7.4개월이 소요됐다.
한편 국내 식약처도 2020년 8월부터 현재까지 FDA의 혁신신약 지정 프로그램과 유사한 생명 위협 질환 및 중대한 질환 치료제 등에 대한 신속심사를 운영 중이다.
올해 9월에는 글로벌 혁신제품 신속심사지원체계(GIFT)를 신설해 글로벌 혁신제품의 심사기간 단축을 통한 빠른 상용화를 지원한다는 계획을 밝혔다.
기존 심사기간의 75% 이하로 심사기간을 단축할 예정이며 글로벌 혁신제품을 개발(임상) 초기부터 신속심사 대상으로 지정한다.
또한 일부 심사 자료는 시판 후에 제출 가능하도록 해 신속한 상용화를 지원하고 있으며, ICH(International Conference on Harmonisation, 국제의약품규제조화위원회)가이드라인 등 글로벌 심사기준은 국내 가이드라인 반영 전에 선제적으로 적용할 수 있도록 지원한다.




![[정책 인사이트] 2027년 지역의사제 속도전…'설계 공백' 논란에도 강행 기조](https://cdn.pharmstoday.com/news/thumbnail/custom/20251126/400494_100525_3125_1763631088_280.jpg)



