MSD·BMS 등 1차 라인 치료 유망한 데이터로 점유 확대 노려
면역항암제 기반 복합 요법들이 치료가 어려운 신세포암에서 우위를 차지하기 위해 치열한 경쟁을 하고 있다.
현재 머크(MSD) 등 체크포인트 억제제를 보유한 4개 빅 파마 기업들이 다른 항암제 TKI와 복합으로 신장암에 대한 유망한 데이터로 점유 확대를 추진하고 있다.
1차 라인 신장암 시장의 지배를 위한 경쟁에서 MSD의 키트루다(Keytruda)와 에자이의 렌비마(Lenvima) 복합요법에 대한 새로운 데이터는 성인에서 가장 일반적인 신장암 종류인 진행성 신세포암의 치료에 대한 추가 가능성을 입증했다.
최근 머크(MSD)는 가상 ASCO-GU(American Society of Clinical Oncology’s Genitourinary Cancers Symposium) 미팅에서 발표한 3상 Clear/Keynote-581 연구의 전체 데이터를 바탕으로 선두를 강화했다.
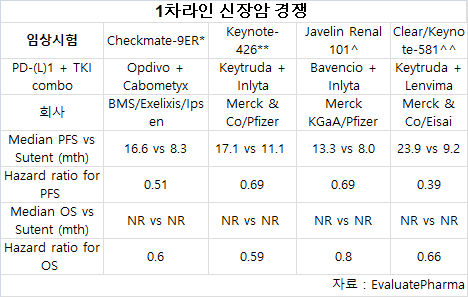
연구에서 체크포인트 억제제 키트루다(pembrolizumab)+렌비마(lenvatinib)와 렌비마+에베로리무스(everolimus)는 진행성 신장암 환자의 1차 라인 치료에 화이자의 TKI(tyrosine kinase inhibitor) 수텐(Sutent, sunitinib)과 비교했다.
3상 시작 당시 화이자의 수텐은 신장암 치료에 표준요법으로 간주됐다.
연구결과 키트루다+렌비마 복합은 무진행 생존(PFS)와 전체 생존(OS) 모두에 대해 통계적으로 유의한 개선을 입증했다.
키트루다+렌비마는 질병 진행 혹은 사망의 위험을 61% 감소했고 사망 위험을 34% 줄였다.
키트루다+렌비바 그룹의 환자들 사이에서 중간값 PFS는 23.9개월인데 반해, 수텐 그룹은 9.2개월이었다.
중간값 OS는 평균 27개월 추적 후 치료 그룹에서 아직 도달하지 않았다.
키트루다+렌비마 복합 그룹의 전체 반응률(ORR)은 71%로 수텐 그룹 36.1%의 약 2배였다.
완전 반응률(CR)과 부분 반응률(PR)의 경우, 키트루다+렌비마는 각각 16.1%, 54.9%로 수텐 그룹 4.2%, 31.9%보다 높았다.
MSD와 에자이는 키트루다+렌비마 복합에 대한 긍정적인 결과 외에, 렌비마+에베로리무스도 수텐에 비해 PFS와 ORR에서 개선을 보였다고 보고했다.
이는 수텐 환자의 9.2개월에 비해 렌비마 + 에베로리무스는 14.7개월의 중간값 PFS와 35%의 질병 진행 또는 사망 위험의 감소가 포함되었다.
하지만, 렌비마+에베로리무스는 수텐에 비해 OS에서 개선을 입증하지 못했다.
MSD는 “이번 임상시험에서, 키트루다+렌비마는 수텐에 비해 우수한 효능을 입증했다. 승인이 되면, 복합요법은 1차 라인 세팅에서 진행성 신세포암 환자에게 중요한 새로운 치료 옵션이 될 가능성이 있다”고 밝혔다.
치열한 경쟁의 장이 열리다
승인되면, 키트루다+렌비마 복합은 BMS의 옵디보+여보이(Yervoy) 복합, 키트루다+화이자의 인리타(Inlyta, axitinib) 등 많은 복합들과 경쟁해야 한다.
MSD의 최대 라이벌은 BMS이다.
BMS와 엑셀릭시스도 진행성 신세포암의 1차 라인 치료에 옵디보(Opdivo, nivolumab)와 카보메틱스(Cabometyx, cabozantinib) 복합에 대한 3상 연구의 새로운 분석을 발표했다.
2년 중간값 추적 후, 옵디보+카보메틱스 복합은 수텐에 비해 우수한 PFS, ORR과 OS을 계속 보여주었다.
옵디보+카보메틱스 복합 요법은 수텐에 비해 중위값 PFS가 2배였고, 또한 화이자 약품에 비해 사망 위험이 34% 감소했다.
옵디보+카보메틱스의 질병 통제율은 88.2%로 수텐 69.9%보다 높았다.
또한 BMS는 옵디보와 여보이의 이중 면역요법이 있다.
이런 복합은 안정적인 생존 결과(4년)에서 구축된 강력한 브랜드 가치를 가지고 있어 이런 약품의 시장을 잠식하기는 긴 시간이 필요할 수 있다.
지난달 BMS와 파트너 엑셀릭스(Exelixis)는 MSD/Pfizer의 키트루다+인리타(Inlyta)와 키트루다+렌비마 복합 등 PD-1 억제제와 TKI 복합인 옵디보와 카보메틱스 복합을 FDA에서 청신호를 받았다.
키트루다+인리타는 물론 독일 머크 KGaA의 PD-l 억제제 바벤시오(Bavencio)+인리타, 옵디보+여보이, 옵디보+카보메틱스 모두 진행성 신세포암의 1차 라인 치료에 승인됐다.
프랑스 Alain Ravaud of the University Hospital Centre Bourdeaux의 연구팀이 NEJM(New England Journal of Medicine)에 게재한 연구에 따르면, 옵디보+여보이 복합은 신세포암 위험성이 중간이거나 약한 환자에게만 사용되는 반면, PD-1/L1 체크포인트 억제제와 TKI의 복합은 모든 환자에게 사용된다.

