첫 크리스프 기술 이용 세포 치료제 승인으로 관심 ↑
에디타스‧빔‧인텔리아 등 유망 바이오텍 주시

최근, 미국 FDA가 겸상적혈구병과 베타 지중해 빈혈증의 치료에 첫 크리스프(CRISPR) 유전자 편집 기술을 이용한 세포 치료제를 승인해, 유전자와 세포 치료제를 개발하는 기업에 대해 관심이 집중되고 있다.
블루버드 바이오는 혈관 폐쇄 이력이 있는 12세 이상 겸상적혈구병(SCD) 환자의 치료에, 세 번째 유전자 치료제 리프게니아(Lyfgenia, lovotibeglogene autotemcel)를 미국 FDA로부터 청신호를 받았다.
같은 날, FDA는 12세 이상 재발성 혈관폐쇄 위기 환자의 SCD 치료에 버텍스 파마슈티컬스와 크리스퍼 테라퓨틱스(CRISPR Therapeutic)의 CRISPR/Cas9 유전체 편집 세포 치료제인 카스게비(Casgevy, exagamglogene autotemcel)를 승인했다.
카스게비는 CRISPR/Cas9 기술을 이용해 유전체 편집을 통해 환자의 조혈 줄기세포를 수정하는 유전체 편집 기술의 일종인, CRISPR/Cas9을 활용하는 첫 FDA 승인 치료제이다.
리프게니아는 HbAT87Q 생산을 위해 환자의 혈액 줄기세포를 유전적으로 수정함으로써 작용하는, 세포 기반 유전자 치료제이다.
이런 치료제의 높은 가격과 부작용을 고려할 때, 약물의 활용에 의문이 제기되고 있다.
그럼에도 불구하고, 혁신적인 치료제에 대한 필요성을 고려할 때, 이 분야는 여전히 변수가 많은 바이오텍 분야에서 주목을 받고 있다.
유망 바이오텍
투자은행인 잭스(ZACKS)에 따르면, 2개 유전자 치료제의 FDA 승인으로 파이프라인에 유망한 후보물질을 보유한 에디타스 메디신(Editas Medicine), 빔 테라퓨틱스(Beam Therapeutics), 인텔리아 테라퓨틱스(Intellia Therapeutics) 등 바이오텍이 집중 조명을 받고 있다.
임상 단계 게놈 편집 업체인, 에디타스는 크리스프 기술을 기반으로 독자적인 유전자 편집 플랫폼을 개발했다.
회사의 선도 프로그램인 EDIT-301(enizgamglogene autogedtemcel)은 SCD와 수혈 의존성 베타 지중해 빈혈 치료에 평가하고 있는 생체 외 유전자 편집 약물이다.
지난 10월, FDA는 EDIT-301을 SCD 치료에 재생의학 첨단치료제(Regenerative Medicine Advanced Therapy) 지정을 허가했다.
에디타스는 SCD에 대한 RUBI 임상험에서 환자를 등록하고 있고 베타 지중해 빈혈에 대해 EdiTHAL 임상에서 환자 등록과 투약을 진행 중이다.
현재까지, 두 임상에서 우수한 내약성과 안전성을 확인했다.
에디타스는 2024년 중반에 추가 업데이트를 공유할 예정이다.
빔 테라퓨틱스의 유전자 편집 기술 파이프라인은 독자적인 베이스 편집 기술을 기반으로 한다.
이것은 DNA에서 이중 가닥 끊김 없이 유전체에서 단일 베이스를 표적으로 하는 정밀 유전자 치료제의 계열을 차별화할 수 있다.
회사는 혈액학, 면역학/종양학, 유전 질환 등 세 가지 질병 영역 포트폴리오에 걸쳐 베이스 편집 기술을 발전시키고 있다.
빔은 BEACON 임상에서 중증 SCD 성인 환자를 대상으로 BEAM-101을 평가하고 있다.
회사는 총 45명의 환자를 목표로 임상시험에 추가 환자를 계속 등록하고 있다.
시험의 초기 데이터는 2024년에 나올 것으로 예상하고 있다.
또한, 빔은 알파-1 항트립신 결핍의 치료에 BEAM-302와 글리코겐 저장 질환 Ia의 치료에 BEAM-301 등, 2개 주요 생체 내 베이스 편집 제품 후보를 개발하고 있다.
회사는 재발/난치성 T세포 급성 림프구성 백혈병/T세포 림프종 치료에 다중 편집 동종 CAR-T 제품 후보인 BEAM-201을 I/II상 연구에서 평가하고 있다.
지난 10월, 빔은 릴리에게 특정 자산과 다른 권리를 부여하는 2.5억 달러 가치의 제휴를 맺었다.
인텔리아는 CRISPR/Cas9 기반 기술을 활용한 잠재적 치료제 개발에 집중하는 임상단계 유전체 편집 회사다.
회사의 주요 생체 내 후보인, 트랜스티레틴(ATTR) 아밀로이드증 치료제 NTLA-2001과 유전성 혈관부종(HAE) 치료제 NTLA-2002는 사람의 표적 조직에 유전자를 정밀하게 편집하기 위해, 정맥 주사를 통해 전신적으로 투여되는 첫 CRISPR/Cas9 기반 치료제 후보이다.
리제네론 파마슈티컬스와 공동 개발하고 있는, NTLA-2001은 ATTR 아밀로이드증에 대한 최초의 단일 용량 치료제가 될 가능성이 있다.
NTLA-2002는 HAE의 핵심 매개체인 총 혈장 칼리크레인(kallikrein) 단백질과 활성을 영구적으로 감소시킬 가능성이 있는, 간에서 칼리크레인 B1 유전자를 제거하도록 설계됐다.
I형 또는 II형 HAE 환자를 대상으로 I/II상 연구에서 평가하고 있고, 내년 후기 단계 연구를 계획하고 있다.
다른 후보는 Alpha-1 항트립신 결핍 관련 폐 질환 치료에 NTLA-3001과 AATD 관련 간 질환 치료에 NTLA-2003 등이 있다.
이밖에도, 많은 바이오바마 기업들이 유전자 및 세포 치료제를 개발하기 위해 제휴, 인수 등을 통해 개발을 경주하고 있다.
2023년 현재까지 8개의 새로운 유전자 치료제가 승인됐다.
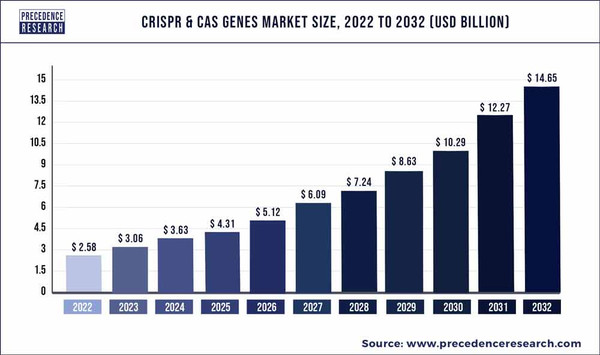
한 리서치 회사는 유전자 치료제 시장이 2032년까지 822억 달러에 이를 것으로 추정하고 있다.
지난 10년 동안 크리스프 기술은 빠르게 발전해 왔고, 잠재적 치료에 대한 파이프라인이 확장되고 있다.
맥킨지앤컴퍼니에 따르면, 현재 임상 개발 중인 세포 및 유전자 치료제는 1000개 이상이 있고, 50개의 유전자 치료제가 향후 몇 년 안에 출시될 예정이다.