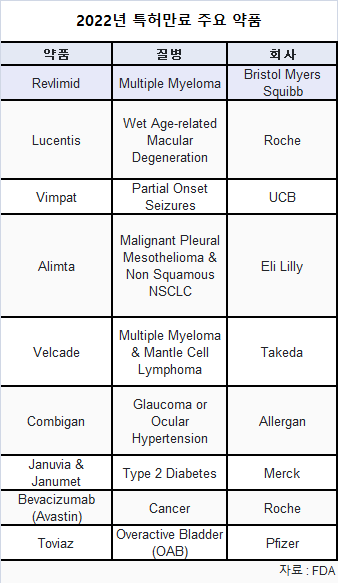
미·유럽, ‘레블리미드’ ‘루센티스’ 등 200억$ 제네릭 경쟁 시작

올해 레블리미드(Revlimid)를 비롯해 아바스틴((Avastin), 루센티스(Lucentis), 자누비아/자누메트(Januvia/Janumet) 등 연간 총매출 200억 달러에 이르는 일부 블록버스터 약품들이 미국과 유럽에서 특허만료에 직면하고 있다.
세엘진이 개발한 레블리미드는 다발성 골수종 치료에 승인된 경구용 항암제이다.
이 약품은 골수형성이상증후군, 외투세포림프종 등 다수 적응증에 사용된다.
레블리미드는 탈로미드(Thalomid, thalidomide)와 화학적으로 관련이 있는 면역조절제이다.
2017년 2월 22일, 레블리미드는 미국 FDA에서 다발성 골수종 환자의 유지요법으로 승인됐다.
2019년 740억 달러에 BMS가 세엘진을 인수했다.
레블리미드는 2020년 121억 달러, 지난해 128억 달러의 매출을 올렸다.
레블리미드는 수년간의 특허 분쟁과 합의 이후 중요한 미국 시장에 제네릭 경쟁에 직면했다.
지난 2월, 산도스, 스타다 아르즈네이미텔(Stada Arzneimittel)은 레블리미드의 제네릭 버전을 유럽에서 판매되고 있다고 밝혔다.
나트코 파마(Natco Pharma), 알보젠(Alvogen), 선 파마(Sun Pharma), 자이두스 카딜라(Zydus Cadila), 시플라(Cipla), 닥터 레이디스(Dr. Reddy's Laboratory), 아포텍스(Apotex) 등 일부 제약사들 레블리미드의 제네릭 개발 경쟁에 있다.
레블리미드 제네릭은 4월 미국 시장에 진출했다.
로슈의 루센티스(Lucentis, ranibizumab)는 습성 나이 관련 황반변성, 망막 정맥 폐색 후 황반부종, 당뇨병성 황반부종, 당뇨병성 망막병증, 근시 맥락막 신생혈관의 치료에 사용된다.
로슈는 미국에서 권리를 보유하고 있고, 노바티스가 세계 나머지 지역에서 독점권을 가지고 있다.
2006년 6월, FDA는 루센티스를 습성 나이 관련 황반변성 치료에 처음 승인했다.
루센티스 특허는 미국에서 2020년에 만료되었고, 유럽에서는 2022년에 만료된다.
일반적으로 많은 블록버스터 약품들은 저가 제네릭과 경쟁에 직면해, 매출은 독점권이 만료되기 직전에 최고조에 달한다.
하지만, 로슈와 노바티스는 이런 경우에 해당되지 않았다.
루센티스는 2021년 로슈가 미국에서 13.5억 달러의 매출을 기록했다.
삼성바이오에피스가 루센티스의 첫 바이오시밀러 버전인 바이오비즈(Byooviz)를 출시할 예정에 있어, 올 가을에 로슈의 매출은 떨어질 것으로 보인다.
FDA는 유럽과 영국에 이어 지난해 9월 바이오비즈를 승인했고, 삼성과 제넨텍의 글로벌 라이선스 협약에 따라 올해 6월 상용화가 이뤄질 예정이다.
종근당, 엑스브란 바이오파마, 코헤러스 바이오사이언스, 바이오에크 등 제약사들도 루센티스 바이오시밀러를 개발하고 있다.
화이자, 산도스, 셀트리온, 바이오콘 등도 루센티스 바이오시밀러 개발에 관심을 가진 것으로 알려졌다.
UCB가 생산하는 빔팻(Vimpat, lacosamide)은 1개월 이상의 성인과 어린이 부분 발병 발작 치료에 사용된다.
경구용 항경련제인 빔팻은 2008년 7월 FDA에서 성인의 부분 발작에 대한 보조 요법으로 처음 승인됐다.
항간질제 빔팻은 제네릭 경쟁에 직면할 것이다.
빔팻은 연방항소법원의 2018년 결정으로, 올해 3월까지 주요 미국 특허에 대한 보호를 받는다.
UCB는 특허만료 1년 전인 작년 빔팻의 최대 매출을 올렸다.
회사는 지난해 빔팻의 매출은 미국에서 11.3억 유로(12.7억$) 등 총 15.5억 유로(17.4억$)를 보고했다.
인도의 오로빈도 파마가 2015년에 빔팻 제네릭에 대한 예비 승인을 받았다.
자이두스 카딜라도 2019년 빔팻 제네릭의 가승인을 받았다.
릴리의 알림타(Alimta, Pemetrexed)는 악성 흉막 중피종, 비편평상피 비소세포폐암 치료에 사용되는 화학요법 약품이다.
알림타는 2004년 2월 미국 FDA에서 악성 흉막중피종 치료에 처음 승인받았고, 2009년 7월 비편평상피 비소세포폐암 치료의 유지요법으로 청신호를 받았다.
알림타의 '비타민 요법 특허'가 오는 5월 만료돼, 제네릭 경쟁사인 비아트리스와 아포텍스가 진입할 가능성이 있다.
또한, 이글 파마슈티컬스는 2월에 제네릭을 가장 먼저 생산했다.
이글은 2월에 제한적인 제네릭 런칭과 4월에 오픈되지 않은 시장 진입의 권리를 발표했다.
반면, 다른 제네릭 제조사들은 미국에서 알림타의 마지막 특허가 만료되는 5월까지 기다려야 한다.
2021년, 알림타의 전 세계 매출은 20.6억 달러로 전년대비 12% 감소했다.
릴리는 일본과 유럽 주요 시장에서 특허 만료로 인한 제네릭 경쟁 진입으로 알림타의 매출 감소가 지속될 것으로 보고 있다.
회사는 2022년 1분기부터 미국에서 제네릭이 출시될 것으로 예상하고 있다.
다케다의 벨케이드(Velcade, Bortezomib)는 다발성 골수종에 대한 표적 치료제이다.
이 약품은 얀센제약과 공동 개발했고, 미국에서 다케다, 유럽과 나머지 지역은 얀센, 일본은 구 회사가 코마케팅하고 있다.
벨케이드는 2003년 5월 13일 처음 승인됐다.
최소 이전 하나의 치료를 받은 외투세포 림프종 환자의 치료에도 허가됐다.
벨케이드 특허도 올해 만료될 전망이다.
벨케이드는 미국 시장에서 상당한 매출을 올렸다.
2021년, 벨케이드는 미국에서 약 9.2억 달러의 매출을 기록했다.
2021년 마지막 분기에, 벨케이드는 미국 시장에서 약 241억 엔(2.1억$)의 매출을 보고했다.
몇 년 동안 일부 제약사들이 벨케이드 제네릭을 제조하려 했고 다케다로부터 소송을 유발했다.
2015년 델라웨어의 미국 판사는 특허에 적용된 화합물의 특허가 무효라고 판결했지만, 2017년, 다케다는 특허가 유효하다고 판단한 항소심에서 승소했고, 벨케이드 특허 보호 기간을 2022년까지 연장했다.
제약사들은 벨케이드 제네릭에 대한 잠정적인 승인을 기대하고 있다.
현재 테바, 밀란, 산도스, 선 파마, 글렌마크 파마슈티컬스, 웍하르트(Wockhardt) 등 제약과 바이오텍 기업이 벨케이드 제네릭 승인을 기다리고 있다.
콤비간(Combigan)은 애브비에 인수된 엘러간이 개발했다.
2007년 10월 30일 FDA 승인을 받았고, 콤비간(brimonidine tartrate/timolol maleate)을 보호하는 10개의 특허가 있다.
이 약품은 IOP의 조절이 불충분하기 때문에 보조요법이나 대체요법이 필요한 녹내장이나 안압의 상승을 줄이기 위해 개발되었다.
2017년 콤비간은 앨러건의 총 매출의 3%를 차지해, 엘러건의 베스트셀링 약품 중 하나가 되었다. 2
2019년 4분기 알파간/콤비간(ALPHAGAN/COMBIGAN)의 총매출은 9450만 달러였다.
2021년 애브비는 콤비간의 글로벌 매출은 연간 62% 급등한 5.3억 달러를 보고했다.
높은 매출은 다른 업체가 콤비간 제네릭 시장에 진출하도록 동기를 부여했다.
2017년 12월 엘러건은 콤비간 제네릭에 대한 산도스의 특허 항소를 방어하지 못했다.
지난 1월 라포텍스는 미국에서 콤비간의 첫 공인된 제네릭을 출시했다.
머크(MSD)의 자누비아(Sitagliptin)와 자누메트(sitagliptin/metformin HCl)는 2형 당뇨병 치료에 사용된다.
자누비아는 2006년 10월, 자누메트는 2007년에 FDA에서 청신호를 받았다.
기본 화합물과 관련된 자누비아 특허는 오는 7월 만료되는 반면, 염과 제품과 관련된 특허는 미국에서 2026년에 만료된다.
2006년 자누비아가 출시 이후, 매출 면에서 MSD의 가장 성공한 제품 중 하나다.
2021년 자누비아/자누메트 프랜차이즈의 매출은 52.9억 달러를 기록했다.
2013년 인도 제약사 선 파마가 자누비아의 제네릭 버전을 FDA에서 임시 승인을 받았고, 올해 출시가 예상된다.
아바스틴은 로슈의 블록버스터 암과 염증성 질환 약품이다.
이 약품은 대장, 전이성 유방암, 진행성 비소세포 폐암, 진행성 또는 전이성 신장암, 자궁경부암, 난소암 등 다수 암 치료에 사용된다.
아바스틴은 2021년에 전년보다 37% 떨어진 31억 스위스 프랑의 매출을 올렸다.
매출 감소의 주요 요인은 미국과 유럽을 중심으로 바이오시밀러 경쟁 때문이다.
유럽에서 매출은 약 4.3억 스위스 프랑이었다.
아바스틴의 특허는 미국에서 2019년 7월에 만료된 반면, 유럽 특허는 지난 1월에 상실했다.
암젠, 엘러간 등 일부 주요 제약사들이 아바스틴 바이오시밀러 시장 진출을 기대하고 있다.
2018년 12월 13일 유럽 의약품청(EMA)의 CHMP는 아비스틴 바이오시밀러인 지라베브(Zirabev)의 마케팅 승인을 권고했다.
2021년 2월 EMA는 아바스틴 바이오시밀러인 mAbxience의 MB02에 대해 마케팅 승인을 했다.
유럽에서는 MB02가 알림시스(Alymsys), 오야바스(Oyavas)로 판매되고 있다.
화이자의 토비아즈(Toviaz, fesoterodine fumarate)는 2008년 10월 과민성 방광 치료에 FDA에서 청신호를 받았다.
토비아즈의 요실금·긴급성·빈도 증상이 있는 과민성 방광 치료에 대한 미국 특허는 오는 7월 3일 만료되며 소아 독점권은 2023년 1월 3일 만료된다.
토비아즈는 2021년 화이자의 매출에 약 2.4억 달러를 추가했다.
2015년 아메리겐 파마슈티컬스가 FDA로부터 토비아즈 제네릭(Fesoterodine Fumarate Extended-release Tablet, 4mg, 8mg)에 대한 ANDA(abbreviated new drug application) 승인을 받았다고 발표했다.
2016년 인도의 제약사 닥터 레이디스는 토비아즈의 제네릭 버전에 대한 ANDA에 대한 FDA의 잠정 승인을 받았다.
2022년 알렘빅도 토비아즈 제네릭에 대해 FDA에서 잠정 승인을 받았다.
특허 보호와 만료는 헬스케어 업계의 뜨거운 화제 중 하나이다.
특허 보호는 의약품의 초기 개발자와 혁신자에게 높은 매출과 이익을 가져오며, 다양한 추정치에 따라 특허 보호 약품의 총 이익률이 90%를 초과하는 경우도 있다.
그러나 특허 만료는 제네릭 경쟁업체의 시장 진입으로 인해 초기 개발자에게 도전장을 던진다.
약물 특허 만료는 초기 개발자가 아닌 다른 제조업체가 저렴한 일반 버전을 도입하는 데 도움이 된다.
제네릭 버전의 약품은 브랜드와 특허 제품보다 거의 20-30% 저렴한 것으로 관찰된다.
소비자들에게 그것은 필수적인 약을 더 낮은 가격에 구할 수 있도록 도와줌으로써 절약의 기회를 제공한다.