미 FDA, ‘린버크’ 이어 ‘올루미안트’ ‘젤잔즈’ 3개월 연기
심장 문제 등 조사...사노피/리제너론 ‘듀피젠트’ 경쟁 한숨 돌려
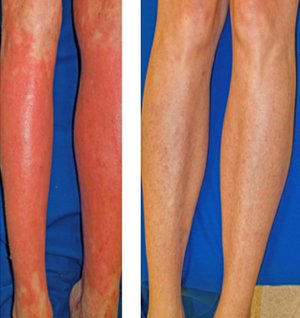
사노피와 리젠너론 파마슈티컬의 빠르게 성장하는 듀피젠트(Dupixent)가 리드하는 아토피 피부염 시장에 일부 JAK 억제제 계열 제품의 라벨 확대 승인의 결정의 연기가 잇따르고 있다.
미국 FDA는 8일(현지시간) 릴리와 인사이트의 올루미안트(Olumiant), 화이자의 젤잔즈(Xeljanz)를 아토피 피부염에 대한 보충신약신청(sNDA) 결정을 3개월 연기했다고 밝혔다.
두 제품 결정은 3분기 초에 나올 것으로 예상된다.
이번 연기 발표는 애브비의 린버크(Rinvoq)에 대한 비슷한 지연에 이어 나왔다.
3개 JAK 억제제에 대한 연기는 올해 초 류마티스 관절염 안전성 연구에서 젤잔즈가 심장 관련된 안전성 문제 증가를 보인 이후 FDA의 계열 전반에 걸친 조사를 반영하고 있다.
올루미안트, 젤잔즈, 린버크는 이미 심각한 감염, 혈전, 암에 대한 박스경고를 라벨에 표기하고 있다.
JAK 계열 중 첫 출시한, 젤잔즈는 이런 위험을 더 자세히 평가하기 위해 시판 후 장기 연구를 수행해야 했다.
젤잔즈는 심장관련 문제와 암의 위험 증가와 관련이 있다고 지난 2월 FDA가 언급했다.
화이자는 처음에 테스트한 더 높은 젤잔즈 용량에 대한 시판 후 연구에서 심장 위험 증가를 확인했다.
하지만, 1월에 업데이트된 데이터에서 낮은 용량도 이런 문제를 보인 것을 발견했다.
FDA가 약품의 기존 적응증에 대한 잠재적 조치를 숙고함에 따라, 현재 전체 JAK 계열에 대한 보류 중인 신청에 대해 면밀히 분석하고 있다.
릴리와 애브비에 대해, FDA는 결정 시한을 연장하기 전에 추가 데이터 분석을 요구했다.
연기는 JAK 개발자들을 좌절시켰지만, 사노피와 레제너논의 듀픽젠트의 경쟁은 다소 지연됐다.
듀픽젠트는 JAK와 비교해 블랙박스 경고를 수반하지 않고 있다.
이러한 안전성 이점 때문에 업계 관계자들은 JAK보다 듀피젠트가 먼저 사용될 것으로 예측했다.
리제너론은 아토피 피부염을 현재 듀피젠트의 최대 적응증이자 주요 성장 동력으로 여기고 있다.
듀피젠트는 작년 매출 40억 달러 이상으로 연간 75% 급증했다.
피부염 적응증 외에도, FDA는 강직성 척추염에 대한 젤잔즈의 결정을 재조정했고, 이전에 린버크도 건선 관절염에 같은 결정을 내렸다.
3개 JAK 중, 처음 출시된 젤잔즈는 류마티스 관절염, 건선 관절염, 궤양성 대장염에서 지난 해 최대 실적인 24.4억 달러의 매출(전년대비 9%↑)을 기록했다.
2018년 중반 류마티스 관절염 치료에 승인을 받은 올루미안트는 EU와 일본에서 아토피 피부염 승인을 받았다.
이 약품은 작년 11월 길리어드 사이언스의 코로나19 치료제 렘데시비르(remdesivir)와 복합으로 긴급사용허가가 일부 기여해, 2020년 연간 50% 급증한 6.39억 달러의 매출을 올렸다.
린버크는 2019년 8월 류마티스 관절염 치료에 미국 FDA 승인을 받았고, 시장 진출 첫 전체 1년 동안 2.81억 달러의 매출을 등록했다.
일부 월가의 애널리스트에 따르면, JAK 억제제에 대한 sNDA의 검토 기간 연장과 다른 부정적인 업데이트는 약물에 국한된 문제가 아니라 JAK 억제제 계열의 약품과 관련이 있을 수 있다.

