美/EU 업체와 개발 제휴…가격 경쟁 등 장점
중국 자체 개발 면역체크포인트 억제제들이 향후 미국 시장을 흔들 수 있다는 보고서가 나왔다.
중국이 혁신 주도형 고품질 개발을 추구함에 따라, 중국 바이오텍 기업들도 보다 강력한 혁신 마인드를 채택해 세계적 수준의 과학적 R&D를 실시하고 첨단 치료법을 개발하고 있다.
이런 회사들은 암 치료에 혁명을 일으키고 종양을 표적으로 하고 살해하기 위해 인체의 면역 시스템에 도움을 줄 잠재력을 가진 매우 경쟁적인 분야에서 일부 자체 개발 PD-1/L1 억제제를 개발하는 데 성공했다.
또한 그들은 글로벌 빅 파마 기업들에게 약물 권리를 아웃 라이선스하고 있다.
최근 암젠이 베이젠과 종양학 약물 개발을 위한 글로벌 협력에 서명했다.
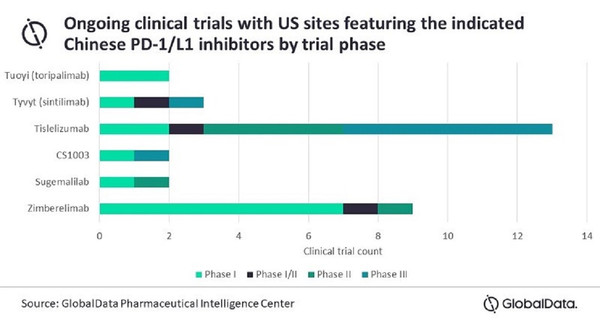
현재 중국 제약사들은 미국이나 유럽 회사와 파트너십을 통해 6개 면역체크포인트 억제제를 개발하고 있다.
준시의 PD-1 억제제 투오이(Tuoyi, toripalimab)에 대한 코헤루스 바이오사이언스와 상하이 준시 바이오사이언스 간의 최근 제휴는 미국이나 EU 기업과 중국 PD-1/L1 개발업체 간의 다섯 번째 이런 딜이다.
데이터와 분석 업체인 글로벌데이터의 최신 보고를 보면, 처음 중국에서 개발돼 미국이나 EU 기업과 제휴한 6개의 체크포인트 억제제가 미국에서 승인을 위해 경쟁하고 있다.
이것은 향후 미국 시장을 뒤흔들 수 있는 공격적인 할인 가격과 기존 체크포인트 억제제에 대한 경쟁 압력으로 이어질 수 있다.
글로벌데이터는 중국 PD-1 억제제 투오이와 이노벤트/릴리의 티빗(Tyvyt, sintilimab)이 중국에서 출시됐을 때, 이런 약품은 경쟁 PD-1 억제제인 머크(MSD)의 키트루다(Keytruda)와 BMS의 옵디보(Opdivo) 보다 상당히 낮은 가격이 될 수 있다고 분석했다.
미국 시장에서의 비슷한 가격 인하는 실제로 빅 파마와 경쟁 시작하는 중국에서 새로 진출하는 기업에서 볼 수 있다.
이런 전략은 더 비용에 민감한 국가에서는 훨씬 더 성공할 수 있다.
미국이나 유럽 회사와 파트너십에 있는 6개 면역 체크포인트 억제제 모두는 최종 단계 연구에 있고 일부 긍정적 데이터를 내놓을 것으로 예상된다.
투오이는 2차 라인 흑색종 환자의 치료에 이미 중국에서 승인됐고 비인두암에 혁신치료제와 희귀약으로 지정됐고, 연조직 육종 치료에 희귀약으로 지정됐다.
티빗은 3차 라인 재발/난치성 고전적 호지킨 림프종에 2019년 중국에서 승인됐다.
이 제품은 중국에서 비소세포폐암에 대한 3상 연구에서 긍정적 결과를 보였다.
하지만, 미국 3상 임상은 식도암에 티빗을 연구하고 있다.
코헤루스와 준시는 올해 말에 비인두암에 투오이의 사용에 대한 BLA(Biologics License Application)을 기대하고 있다.
현재 미국 임상은 진행 중인 반면, 대부분의 임상 데이터가 아시아에서 나올 예정에 있고, 미국 FDA가 이를 어떻게 처리할지는 미지수다.
베이젠이 처음 개발하고 노바티스와 제휴한 가장 앞선 후보는 티슬리주맙(tislelizumab)이다.
3상에 6개 등 현재 티슬리주맙에 대한 13개 미국 기반 임상시험이 13개 있어, 이는 첫 미국 승인에 좋은 징조가 될 수 있다.
티슬리주맙의 긍정적 중간 결과는 각각 이전에 치료한 식도암과 비소세포폐암 환자에 대해 Rationale 302와 Rationale 303 임상시험 모두에서 보고되었다.
베이진은 어떤 적응증에 첫 신청할지는 알 수 없지만, 가까운 시일 내에 FDA에 신청할 가능성이 높다고 밝혔다.
비소세포암 분야는 키트루다(pembrolizumab)가 장악하고 있다.
반면, 키트루다와 옵디보(Nivolumab)는 최근 식도암에 적응증을 추가했다.
이것은 이런 상대적으로 작은 적응증을 베이진에게 더 매력적인 첫 승인이 될 수 있고 다른 중국 PD-1 억제제가 미국 시장에 진입할 수 있는 기반을 마련할 수 있게 한다고 글로벌데이터가 밝혔다.
아르쿠스 바이오사이언스(Arcus Bioscience)는 PD-1을 결합하는 단클론항체인 짐베렐리맙(zimberelimab, AB122)을 비소세포폐암, 전립선암, 췌장암 등 다양한 암에 9개 임상시험이 진행 중에 있다.
회사 웹사이트를 보면, 짐베렐리맙의 가장 앞선 연구는 항TIGIT 단클론항체인 돔바날리맙(domvanalimab)과 클리닉에서 최초이자 유일한 이중 A2a/A2 아데노신 수용체 길항제인 에트루마데난트(etrumadenant)와 복합으로 짐베렐리맙을 평가하는 1차 라인 전이성 비소세포폐암의 치료에 2상 임상시험이다.
짐베렐리맙은 승인된 항PD-1 치료 옵션이 없는 암에 대해 종양 불가지론적이고 바이오마커 선택한 1b상 임상시험에서 단독요법으로 평가하고 있다.
씨스톤 파마슈티컬(CStone Pharmaceuticals)은 다양한 종양에 PD-1을 표적으로 인간화 재조합 IgG4 단클론항체 CS1003을 개발하고 있다.
회사 측에 따르면, 작년 7월, 미국 FDA에서 간세포암 치료에 CS1003을 희귀의약품 지정을 받았다.
현재 CS1003의 1상 임상시험은 호주, 뉴질랜드, 중국에서 진행 중에 있다.
또한 글로벌 멀티센터에서, 진행성 간세포암 환자의 1차 라인 치료에 렌바티닙(lenvatinib)과 복합으로 CS1003의 안전성과 효능을 평가하는 3상 연구는 환자 등록을 시작했다.