강진형 교수 "항암제 성공은 부작용 줄이는데 있어"
"올리타, 프리젠테이션만 하고 퍼블리쉬 없어" 지적
13일 프라자호텔에서 열린 아스트라제네카 타그리소 급여출시 기자간담회에서 경쟁 약물인 한미약품의 올리타에 대한 의료진의 냉정한 평가가 나왔다.
이와 함께 타그리소의 급여 진입 과정과 관련해, 보건당국이 신약의 급여 기준을 타당해게 설정해야 한다는 의견도 나왔다.

지난 5일 보험 급여 장벽을 넘은 아스트라제네카의 타그리소(성분 오시머티닙)의 급여 진행 과정에 대해서는 "공산품이든 제품이든 가격이 결정되는 것에 있어 원가라는 것이 있다"면서 "우리나라 약가 책정에서 원가가 높이 책정된 것으 아니라는 시선이 있고, 신약은 연구개발에 투자가 많은데 이를 (정부가 약가산정에서)빼고 싶은 것이 아닐까한다"고 개인적 견해를 드러냈다.
그는 "경쟁약물이 워낙 낮게 약가를 제시하다 보니 대체약이 있는 공단이 약가협상을 주도하게 됐다"면서 "약에 대한 적정한 평가는 공정성이 먼저냐 평등성이 먼저인가를 따져야 하는데 (올리타 급여에 있어서)잘 되지 않은 것 같다"고 말했다.그는 "올리타는 미국에서 프리젠테이션만 하고 퍼블리시된 것이 없다"고 지적하면서 "이런 약제를 한국만 급여한다는 것 자체가 공정한지는 생각해봐야 할 것"이라고 전했다.
김수연 상무는 "급여 받는 과정이 쉽지 않았다. 약제를 철수한다는 것은 한국환자에게 할 수 없는 일이라고 생각해 본사와 커뮤니케이션을 지속하며 문제를 해결하려 노력했다"고 전했다.타그리소, 폐암 내성환자 치료하는 유일한 약제
김수연 아스트라제네카 항암제사업부 상무는 "3상 임상을 통해 효과를 확인한 유일한 치료제이며 폐암 내성 치료의 시대를 연 3세대 치료제"라고 의미를 부여하면서 "타그리소는 전세계 환자를 대상으로 한 임상에서 1호 환자가 한국인이었다. 한국에서 급여 진입은 의미하는 바가 크다"고 전했다.
강진형 교수는 임상 3상의 의의를 소개하며 "무진행 생존기간은 비아시아인보다 아시아인에서, 중추신경계 전이되지 않은 환자보다는 중추신경계 전이를 동반한 환자에서 타그리소는 표준 요법 대비 의미 있는 무진행 생존기간 개선을 나타냈다"면서 "AURA3상 임상에 참여한 72명의 한국환자 하위 분석에서도 객관적 반응율 75.8%, 질병조절율 95.5%, 무진행 생존기간 중간값 11개월로 2상 통합분석과 일관된 결과를 보였다"고 설명했다.그는 "폐암 치료제의 내성은 환자에게는 가장 두려운 존재이며, 진료진에게는 가장 걱정스러운 문제"라면서 "타그리소는 이를 극복했을 뿐 아니라 여러 임상시험에서 우수한 효과와 내약성을 일관되게 보여준, 환자에게는 정상적인 생활이 가능한 편안한 삶을 제공하는 치료제"라고 평가했다.
이어 "전체 1,101 명의 폐암 환자 중 약 22%에 해당하는 239명의 한국인 폐암 환자가 참여한 1,2,3상 연구를 통해 우리나라 폐암환자에서의 효과와 안전성 역시 충분히 확인된, 환자를 위한 최적의 치료 옵션"이라고 강조했다.김혜련 연세암병원 종양내과 교수는 "타그리소는 국내 말기 폐암 환자, 특히 이전에 치료 대안이 전혀 없었던 중추신경계 전이를 동반한 다수의 환자에서 이미 실질적인 치료 성과를 나타내고 있다"면서 "이러한 환자들은 언어 장애와 같은 신체 활동 및 일상 생활의 제한을 겪게 되는데, 타그리소의 우수한 효과를 통해 환자들의 삶의 질이 크게 개선된다. 의료진으로서는 많은 국내 연구자들과 환자의 적극적인 참여로 개발된 타그리소가 전 세계 폐암 치료의 기준이 되었다는 점에서도 의미가 깊다"고 말했다.

이는 기존 표준요법인 백금기반 이중 항암화학요법군의 4.4개월 대비 2배 이상 연장된 결과이다(HR=0.30; 95% CI: 0.23,0.41; P<0.001). 객관적 반응률(Confirmed ORR) 역시 백금기반 이중 항암화학요법군은 31%인 것에 비해 타그리소 치료군은 71%로 높았다.
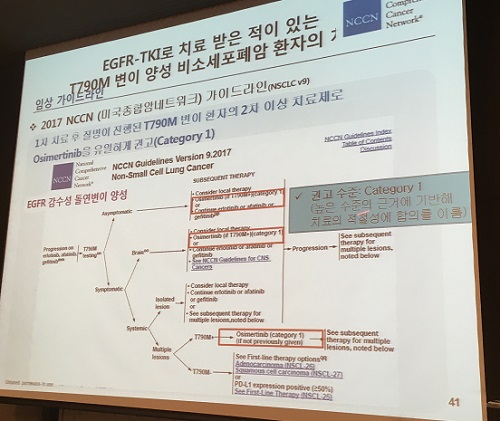
타그리소는 미국종합암네트워크(NCCN)에서 발표한 EGFR T790M 변이 양성 비소세포폐암 환자의 치료를 위한 가장 높은 권고 등급인Category 1을 받은 바 있다. 미국종합암네트워크의 가이드라인에서 권고되는 3세대 EGFR-TKI은 타그리소가 유일하다.
