항암제 31% 차지…화이자 6개로 최다 승인
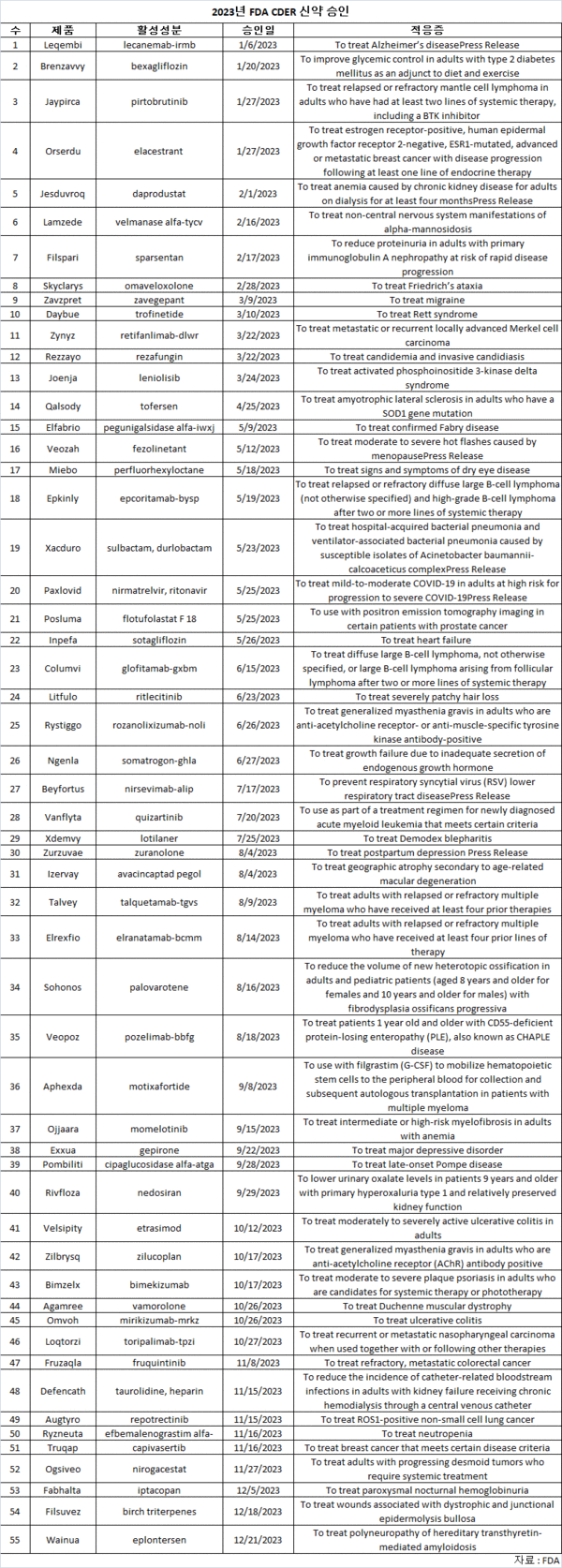
미국 FDA의 CDER(Center for Drug Evaluation and Research)는 올해 지금까지 56개의 신약을 승인했다.
CDER가 2016년 이후 승인한 신약의 수가 가장 적은, 2022년 37개보다 51% 증가했다.
56개 신약은 바이오로직 승인은 제외했다.
백신, 유전자 편집 약물, 면역글로불린 제품 등 제품은 FDA의 CBER(Center for Biologics Evaluation and Research) 소관이다.
컨설팅업체 LEK 컨설팅의 분석에 따르면, 올해 CDER 승인을 받은 가장 많은 치료 분야는 전체 청신호의 31%를 차지한, 종양이다.
승인을 받은 주목할 항암제는 릴리의 자이피카(Jaypirca), 애브비/젠맙의 엡킨리(Epkinly), 다발성 골수종 치료제인 J&J의 엘렉스피오(Elrexfio)와 화이자의 탈베이(Talvey) 등이다.
신경계와 자가면역 질환을 표적으로 한 약물은 각각 전체 승인의 11%를 차지했다.
바이오젠/에자이는 지난 1월 가속 경로로 알츠하이머병에 대한 항아밀로이드 항체 레켐비(Leqembi)를 승인받았다.
또한, 아카디아 파마의 레트증후군 치료제 데이뷰(Daybue)와 세이지/바이오젠의 우울증 치료제 주주배(Zurzuvae)도 청신호를 받았다.
자가면역 질환에, 화이자와 릴리가 각각 궤양성 대장염 치료제 벨시피티(Velsipity)와 옴보(Omvoh)를 승인받았다.
6개 신약으로, 올해 화이자가 CDER에서 최다 신약 승인을 주도했다.
주목할 만한 신약은 경구용 코로나19 치료제 팍스로비드(Paxlovid)의 완전 승인 등이다.
바이오젠과 아스트라제네카(AZ)는 각각 4개, 3개의 승인으로 2위와 3위를 차지했다.
다른 주요 제약사로는 GSK, BMS, 리제네론, 로슈, 노보 노디스크, 사노피, 노바티스 등이다.
아스텔라스 파마, 다이이찌산쿄, 다케다 등 일본 빅파마도 주목할 승인 업체이다.
이밖에, 성공적인 약물 승인 업체는 테라베러 테라퓨틱스(Travere Therapeutics), UCB, 인사이트(Incyte), 사이다라 테라퓨틱스(Cidara Therapeutics), 파밍(Pharming Group), 프로탈릭스 바이오테라퓨틱스(Protalix BioTherapeutics), 바슈롬(Bausch + Lomb) 등이다.
또한, 렉시콘 파마(Lexicon Pharma), 옵코 헬스(OPKO Health), 아미쿠스 테라퓨틱스(Amicus Therapeutics), 코헤러스 바이오사이언스(Coherus BioSciences), 스프링웍스 테라퓨틱스(SpringWorks Therapeutics), 코메딕스(CorMedix) 등도 리스트에 올랐다.
한편, FDA의 CBER은 현재까지 17개 백신이나 바오로직을 승인했다.
주목할 승인은 첫 호흡기세포융합바이러스(RSV) 백신인 GSK의 아렉스비(Arexvy)와 화이자의 아브리스보(Abrydvo) 등이다.