ADC‧CAR-T, mRNA 등 차세대 바이오치료제로 확대
PD-1 등 면역항암제 임상 감소세
종양 연구와 개발(R&D)이 지난 10년간 암 치료를 위한 혁신적인 활성 메커니즘과 함께 가장 뜨거웠던 체크포인터 억제제가 점차 시들해진 한편 표적 약물에 대한 초점이 증가하고 있다.
임상시험업체인 IQVIA의 최신 보고서(Global Oncology Trends 2023 Outlook to 2027)를 보면, 항체 약물 접합체(ADC)는 현재까지 전 세계적으로 승인된 15개로 광범위한 대상에 걸쳐 상당한 효과를 가지고 등장했다.
6개의 이중특이 항체가 종양에 대해 마케팅되고 있고, 130개 이상의 항체가 개발 중인 것으로 나타났다.
CART 세포 치료와 mRNA 백신 연구에서 크게 성장하면서, 차세대 바이오치료제 파이프라인이 확장되고 있다.
ADC
ADC는 암 치료를 위해 더욱 광범위하게 연구되고 있고 표적 화학요법을 가능케 하는, 세포독성 물질과 관련된 단클론 항체로 구성돼 있다.
암에 대해 승인된 첫 ADC인 화이자의 마이로타그(Mylotarg, gemtuzumabozogamicin)는 2000년에 가속 승인을 받았으나 심각한 안전성 문제로 인해 이후 시장에서 철수되었다가 2017년에 재승인됐다.
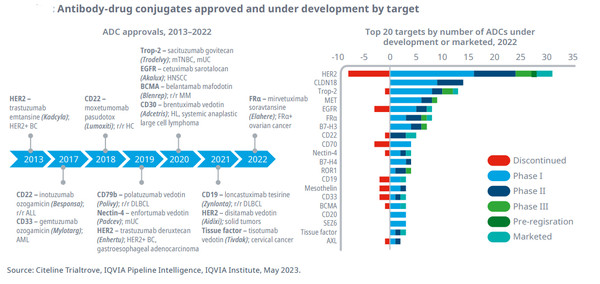
2000년 이후, 15개 ADC가 12개의 다른 표적과 혈액암, 고형 종양에 승인됐다.
중단된 연구로 차질에도 불구하고, 28개 제품은 HER2, CLDN18에 14개, 고형 종양에 발현되는 일반 항원인 Trop-2에 12개 등. 현재 진행 중인 ADC 연구에 76개 바이오마커 표적이 있다.
한때 ADC에 유망한 것으로 생각했던 36개의 표적은 더 이상 연구하지 않고 있어, 암 환자에 대한 상당한 이점을 제공할 수 있는 화합물 개발의 어려움을 보여주고 있다.
중요한 진전은 ADC의 개발에서 이루어졌고, 향후 연구는 새로운 표적, 다른 세포독성 물질, 다양한 분자 구조, 전통적인 화학요법보다 환자에 대한 치료를 개선하기 위한 다양한 적응증에 초점을 맞출 것으로 예상된다.
BiTE(bi-specific T-cell engagers)인 블리나투모맙(blinatumomab), 테벤타부스프(tebentafusp) 등 혈액암과 고형종양에 각각 3개 등, 현재 암 치료에 6개의 이중특이 항체가 마케팅되고 있다.
130개 이상의 이중특이 항체가 현재 개발 중이고, 고형 종양 치료에 67%, 혈액암 치료에 24%, 두 가지 모두에 약 9%가 평가되고 있다.
혈액암과 고형종양에 각각 7%, 5% 만이 3상 연구에 있다.
이중특이 항체는 혈액암에서 주요 표적인 다발성 골수종, 비호지킨 림프종과 비소세포 폐암, 식도암, 고형 종양 등 다양한 암에 대해 테스트하고 있다.
이중특이 항체의 개발이 진전됨에 따라, 삼중특이항체 등 새로운 다중특이 항체가 등장했다.
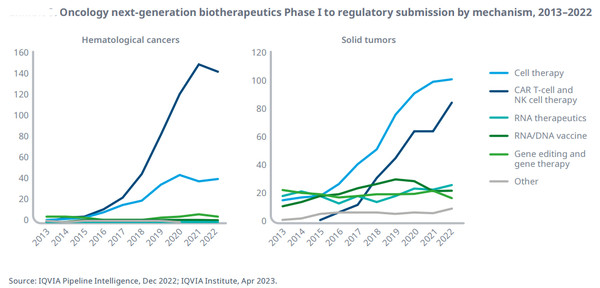
2022년, 혈액암에 대한 차세대 바이오치료제 개발은 10년 전 14개에서 194개로 급등했고, 고형종양에 대해서는 73개에서 254개로 증가했다.
모든 치료 분야에서, 종양학은 차세대 바이오치료 파이프라인의 42%를 차지해, 암 환자의 치료 개선을 위해 이러한 제품 사용을 위한 상당한 연구를 보여주고 있다.
CAR-T
CAR(Chimeric antigen receptor) T-세포와 자연 살해(NK) 세포 치료제는 혈액 암에 대한 차세대 바이오치료제 파이프라인의 74%를 차지하고, 위암, 비소세포 폐암, 간암에 대해 개발 중인 다수의 CART 치료제 등, 고형 종양에 대한 테스트가 점점 증가하고 있다.
코로나19 예방에 mRNA 백신의 급속한 발전과 마케팅 이후, 종양 분야에서 오랫동안 연구되어 온 RNA와 DNA 백신이 새로운 관심을 받고 있다.
과거에 CRISPR 등 유전자 편집 기술을 포함한 유전자 치료제가 개발 중인 차세대 종양 바이오치료제의 더 큰 비중을 차지했지만, 연구는 최근 수년간 임상시험에서 많은 부작용으로 인해 둔화되고 있다,
하지만, 이것은 이러한 제품을 조사하는 동안, 여전히 중요한 가능성을 제공할 수 있는, 환자의 안전성을 보장하기 위한 사전 안전성 계획의 실행을 유도했다.
첫 CART 세포 치료제인 티사겐레클루셀(tisagenlecleucel)이 2017년 급성 림프구성 백혈병(ALL)의 치료에 승인됐다.
이후, 다양한 재발/난치성 혈액 암의 치료에 다른 6개의 CAR T-세포 치료제가 출시됐다.
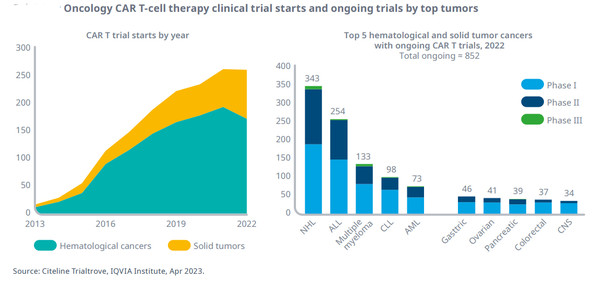
2022년, 264개 임상이 종양에서 CAR T의 사용을 평가하기 시작했다.
고형 종양 임상시험 시작은 30% 증가한 반면, 혈액암은 11% 감소했다.
역사적으로, 연구의 70% 이상이 혈액 암에 대한 것이었지만, CART 연구의 비율은 고형종양에 대해 2017년 임상 시작의 22%에서 2022년에 34%로 증가했다.
2022년, 진행 중인 852건의 CART 시험 중, 72%가 혈액암 치료를 위해 CAR T를 평가하고, 이 중 343건은 비호지킨 림프종 환자에서 테스트하고 있다.
현재 진행 중인 임상 시험의 28%만을 차지하는, 고형 종양에 대한 CAR T-세포 치료제는 위암과 췌장암 등 치료가 어려운 다양한 암에서 조사되고 있다.
진행 중인 연구의 98%가 1상 또는 2상에 있지만, 현재 미국에서 시판되고 있는 모든 CAR T는 1상 또는 2상의 데이터를 근거로 승인됐다.
mRNA
코로나19 대유행은 mRNA 백신에 대한 관심을 증가시켰고, 이런 백신이 개발되는 속도는 종양에서 mRNA 백신에 대한 수십 년간의 연구 덕분이었다.
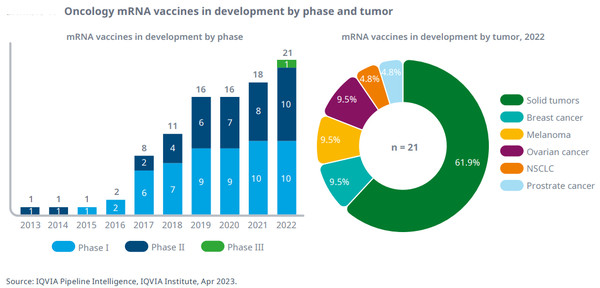
종양은 코로나 이전 mRNA 백신 파이프라인의 가장 큰 비중을 차지했지만, 종양 중심 mRNA 백신은 그 이후 크게 늘지 않았고 2022년 파이프라인의 8%를 차지했다.
암 치료에 mRNA 백신 개발은 고형 종양 치료에 전적으로 초점을 맞추고 있고, 40% 미만이 특정 고형 종양 적응증을 타깃으로 하고 대부분은 진행성 고형 종양이 표적이다.
mRNA 백신이 암 치료를 위해 단독으로 시험되고 있는 반면, 많은 백신들은 종양에 대한 신체 면역 반응을 향상시키기 위해, PD-1 체크포인트 억제제 등 면역항암제와 복합으로 테스트하고 있다.
MSD와 모더나는 키트루다 단독에 비해 고위험 흑색종 환자에서 재발 또는 사망 위험을 44% 감소시킨, 키트루다와 복합으로 mRNA-4157에 대한 긍정적 2상 연구결과를 보고했다.
임상시험
종양에서 전체 성공률은 2022년 3.5%로 떨어져, 2015년 이후 하락 추세이지만, 혈액암은 여전히 가장 높았다.
임상시험은 중국에서의 활동 증가에 의해 미국 이외에서 더 많이 시행되고 있다.
전 세계 종양 임상시험의 대상자 수는 2022년에 약 29만 명으로 3% 감소했다.
종양에 대한 임상 개발 생산성 지수는 모든 질병 중 가장 낮은 수준으로 10년간 지속된 추이를 이어갔다.