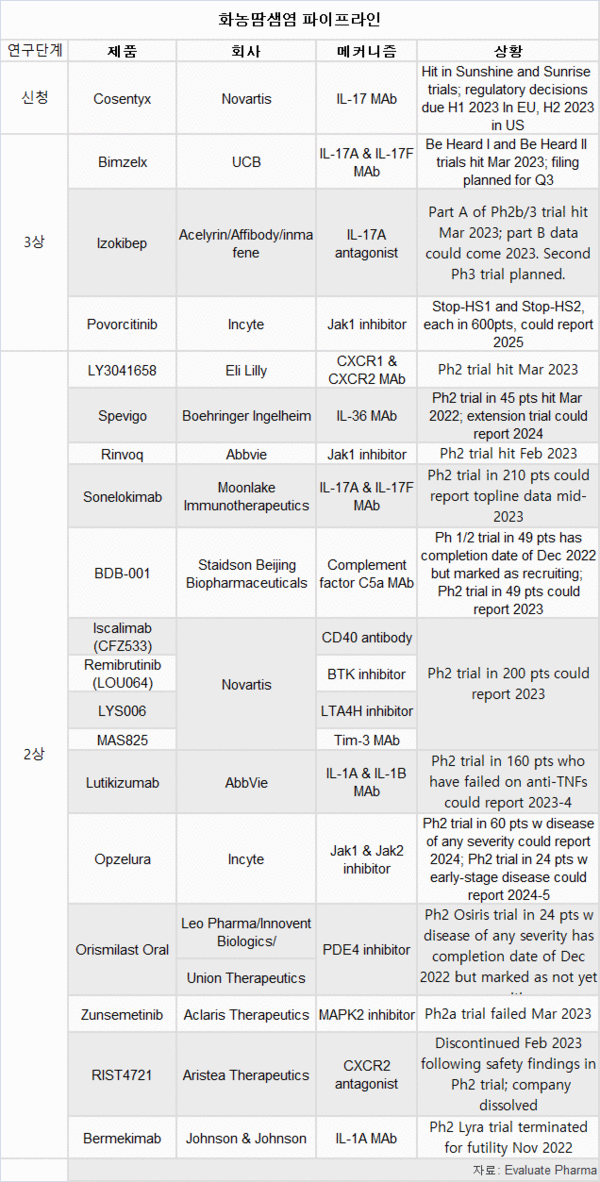
기존과 새로운 약품 개발 경주…노바티스‧UCB 선두
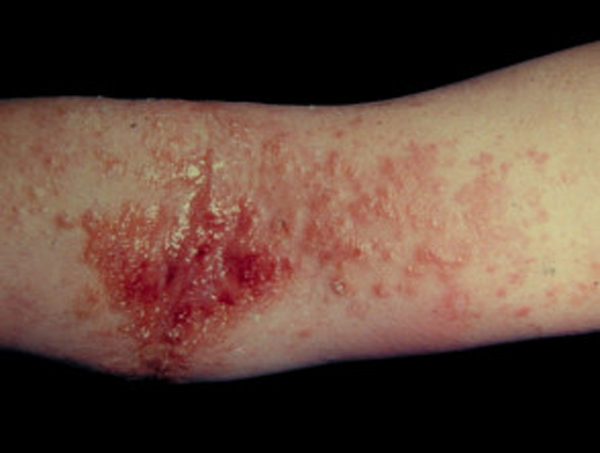
일부 면역 약품이 수십억 달러 가치의 잠재력이 있는 화농땀샘염(hidradenitis suppurativa) 시장을 공략하기 위해 경주하고 있다.
10여개의 중간 단계 임상시험 등, 많은 프로젝트들이 화농땀샘염을 표적으로 개발 중에 있다.
화농땀샘염(HS)은 땀샘이 있는 신체 부위에 고통스럽고, 종기 재발을 유발하는, 모낭의 자가면역질환이다.
시장 리서치 업체인 EP(Evaluate Pharma)에 따르면, 현재 HS 시장 규모는 6억~9억 달러로 추정되고, 수십억 달러의 시장 기회가 될 수 있을 것으로 전망하고 있다.
현재 HS 치료에 승인된 유일한 바이오 약품은 애브비의 휴미라(Humira)와 그의 바이오시밀러 버전이다.
일부 회사들은 기존 자가 면역 항체를 HS 치료에 리퍼포징(약물재창출)하고 있고, 다른 회사들은 완전히 새로운 약물의 개발을 위해 연구하고 있다.
기존 약품을 이용한 전략으로, 가장 앞선 회사는 노바티스와 UCB이다.
노바티스는 작년 9월, IL-17 억제제 코센틱스(Cosentyx)의 중요 HS 임상시험이 성공했고. 유럽연합(EU)과 미국에 라벨 확대 승인을 신청했다고 밝혔다.
코센틱스는 이미 플라크 건선과 건선 관절염 등 5가지 자가면역 질환에 승인됐다.
IL-17A/17F 억제제인 UCB의 빔젤렉스(Bimzelx)는 유럽에서만 2021년 건선 치료에 승인됐다.
지난 3월, 미국 피부과 학회(AAD) 연례 미팅에서 발표한, Be Hear I, II HS 임상시험의 결과는 긍정적이었다.
교차 임상 기준으로, 빔젤렉스는 코센텍스보다 더 우수했고 휴미라와 거의 동등한 수준을 보였다.
AAD 미팅에서, 아셀리린(Acelyrin)도 이조키벱(izokibep)에 대한 3상 연구 데이터를 공개했지만, 임상의 첫 번째, 통제되지 않은 부분이었다.
3상 임상에 있는 유일한 잠재적 HS 치료제는 인사이트의 JAK 1 포보시티닙(povorcitinib)이다.
2상 연구에서, 4개월 동안 포보시티닙을 받은 환자는 위약군보다 농양과 염증성 결절의 수가 유의하게 감소함을 보였다.
2개 3상 시험은 1차 목표로 다른 측정치를 사용한다.
HiSCR50을 달성하는 비율은 농양 또는 배수 터널 수 증가없이, 전체 농양과 염증성 결절 수에서 최소 50% 감소로 정의했다.
이것은 코센틱스와 빔젤렉스의 연구에서 사용된 척도이다.
AAD에서, 릴리는 CXCR1 & CXCR2 억제제인 LY3041658(eltrekibart)에 대한 2상 연구 데이터를 공유했다.
4개월 동안, LY3041658를 받은 환자의 66%가 HiSCR50에 도달한 반면, 위약군은 41%였다.
애브비는 린버크(Rinvoq)로 약간 뒤쳐져 있다.
2상 시험에서, 3개월 동안 JAK1 억제제 린버크를 받은 환자의 38%가 HiSCR50에 도달한 반면, 위약군은 25%였다.
문레이커 임뮨노테라퓨틱스(Moonlake Immunotherapeutics)는 IL17A/17F와 알부민을 표적으로 하는 삼중특이 나노바디 소넬로키맙(sonelokimab)을 2상 임상에서 평가하고 있다.
2상 임상시험은 HiSCR75가 최종목표로, 위약과 휴미라 모두에 대해 소넬로키맙의 2가지 용량을 테스트하고 있다,
AAD에서, 베링거인겔하임은 IL-36 단클론항체 스레비고(Spevigo)를 12주 동안 투여한 환자의 39%가 HiSCR의 감소를 보인 반면, 위약군은 35%였다고 보고했다.
작년 말, 키메라 테라퓨틱스는 화농땀샘염과 아토피 피부염 환자를 대상으로 KT-474를 평가한 1상 임상에서 긍정적인 결과를 발표했다.
회사는 올해 2상으로 진입을 목표로 하고 있다.
아리스테아 테라퓨틱스(Aristea)는 CXCR2 길항제인 RIST4721을 2a상 연구에서 HS 치료에 대해 평가하고 있다.
이밖에도, 인플라알엑스(InflaRx), 케모센트릭스(ChemoCentryx), CSL Behring, 아조라 테라퓨틱스(Azora Therapeutics) 등이 새로운 화농땀샘염 치료제의 개발을 위해 노력하고 있다.