그래파이트‧에디타스 등 개발 경주…블루버드 ‘렌티글로빈’ 가장 앞서
최근 겸상적혈구병(SCD)에 대한 FDA의 승인에도 불구하고, 질병의 근본 원인을 치료할 수 있는 약품에 대한 미충족 욕구가 여전히 있어, 개발 중인 유전자 치료제에 관심이 쏠리고 있다.
SCD는 비정상적인 낫 헤모글로빈의 생성으로 이어지는, 세계에서 가장 오래된 유전병으로 불린다.
SCD의 치료에 FDA에서 이미 승인된 다수 약품이 있다.
2017년, 엠마우스 라이프사이언스의 엔다리(Endari, L-glutamine oral powder)가 약 20년 만에 첫 새로운 SCD 치료제가 됐다.
2019년, GBT(Global Blood Therapeutics)는 질병의 근원을 표적으로 하는 첫 약품인 옥스브리타(Oxbryta, voxelotor)를 FDA에서 청신호를 받았다.
같은 해, 노바티스는 16세 이상 SCD 환자의 상의 성인 및 아동의 혈관폐색 위기(VOC)의 발생 빈도 감소에 아닥베오(Adakveo, crizanlizumab-tmca)를 승인받았다.
2021년, 치에시(Chiesi)의 페리프록스(Ferriprox)는 SCD나 다른 빈혈로 인한 수혈 철 과다의 치료에 라벨 확대 승인을 받았다.
그래파이트 바이오(Graphite Bio), 블루버드 바이오(bluebird bio), 버텍스 파마슈티컬스(Vertex Pharmaceuticals), 에디타스 메디신(Editas Medicine) 등 많은 바이오파마 기업들이 SCD에 대한 유전자 치료제를 도입하기 위해 경주하고 있다.
그래파이트 바이오는 SCD의 근본 원인을 타겟으로 I/II상 CEDAR 임상에서 nula-cel(nulabeglogene autogedtemcel)을 평가하고 있다.
회사에 따르면, Nula-cel은 유전자 변이를 교정하고 정상버전으로 유전자를 바꿀 수 있는 잠재력을 가진 모든 종류의 환자에게 투여되는 첫 치료제이다.
블루버드 바이오는 lovo-cell(lovotibeglogene autotemcel)을 테스트하고 있다.
현재 18세 미만 환자에 대한 부분적인 임상 보류 상태이지만, 블루버드의 SCD에 대한 임상 중인 렌티글로빈(LentiGlobin) 유전자 치료제는 약 8년간의 추적 데이터와 함께 50명 이상의 환자에게 투여됐다.
등록 코호트는 약 30명의 환자를 포함하고 있다.
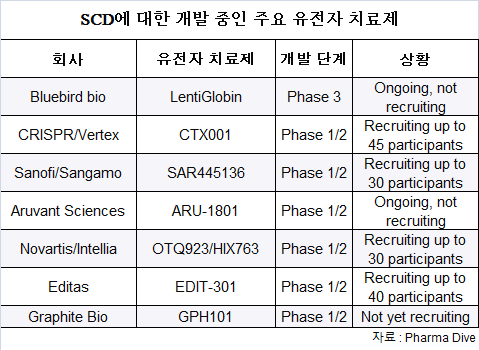
현재까지 FDA는 lovo-cel을 희귀 의약품, 패스트트랙, 재생의학 선진 치료제(RMAT) 지정, 희귀 소아 질환 지정을 허가했다.
블루버드는 2023년 초에 lovo-cel에 대한 BLA(Biologics License Application)을 FDA에 제출할 예정이다.
최근 버텍스와 파트너 크리스퍼 테라퓨틱스(CRISPR Therapeutics)는 11월 exa-cell(exagamglogene autotemcel)에 대한 BLA를 제출할 계획을 밝혔다.
제출은 FDA에 대한 롤링 검토의 일환이고 2023년 1분기 말까지 완료될 것으로 예상된다.
Exa-cel은 겸상적혈구와 다른 혈액질환인 베타 지중해빈혈 모두에 대해 개발되고 있다.
자가 조직, 생체 외 CRISPR/Cas9 유전자 편집 치료제인, exa-cel은 높은 수준의 태아 헤모글로빈을 생성하기 위해 환자 자신의 조혈모세포를 편집한다.
지난 7월, 에디타스는 임상 중인 유전자 치료제 EDIT-301의 긍정적인 업데이트를 공유했다.
현재 1/II상 RUBY 임상에서 연구되고 있는, 후보 치료제는 BCL11a의 결합 부위를 교란시키고 SCD의 증상을 개선하기 위해 HBG 1/2 프로모터를 편집하도록 설계되었다.
임상시험에서 첫 환자의 성공적 호중구 및 혈소판 생착을 확인했고, 재주입에 대한 대비에서 환자로부터 CD34+ 세포를 성공적으로 편집했다고 에디타스가 밝혔다.
EDIT-301은 SCD와 베타 지중해빈혈 모두의 치료에 희귀소아질환으로 지정됐다.
이밖에도, 노바티스, 화이자 등 빅 파마를 비롯해, 시로스 파마슈티컬스(Syros Pharmaceuticals), 사나 바이오테크놀로지(Sana Biotechnology), CSL Behring, 산가모 테라퓨틱스(Sangamo Therapeutics), 바이포 파마(Vifor Pharma), 이마라(Imara) 등 많은 바이오파마 기업들이 SCD 치료 지형을 변화시키기 위해 잠재적 약품 후보를 개발하고 있다.
이런 개발 중인 유전자 치료제와 약품들이 승인될 경우, 전 세계 수백만 명의 SCD 환자의 치료 패러다임을 변화시킬 수 있는 잠재력을 가지고 있다.

