AZ/MSD ‘린파자’ 시장 주도…’제줄라‘ ’루브라카‘ 추격전
아스트라제네카(AZ)와 머크(MSD)가 주도하고 있는 PARP 억제제 시장에서 GSK, 클로비스 온콜로지 등이 난소암, 전립선암 등으로 적응증 확대를 위해 경주하고 있다.
FDA는 분명한 종양 진행 이익에도 불구하고 말기 난소암 치료에서 장기 환자 생존에 대한 PARP 억제제 계열 약물의 잠재적 해로운 영향에 대해 우려를 제기했다.
최근 AZ/MSD의 린파자(Lynparza), GSK의 제줄라(Zejula), 클로비스의 루브라카(Rubraca)는 미국에서 말기 난소암 적응증에 모두 철회했다.
이런 우려가 제줄라를 더 위축시킬 수 있다.
미국 자문위원회는 11월 22일 미팅에서 난소암 유지 요법으로 제줄라의 사용을 축소할지를 논의할 예정이다.
이에 대한 근거는 이 세팅에서 무진행 생존 이익이 제줄라의 미국 승인을 뒷받침했지만, 전체 생존 데이터는 제줄라 환자가 위약군보다 더 나쁜 것으로 나타난, Nova 임상시험이다.
11월, 자문위에서 이슈는 2차 최종목표인 Nova의 전체 생존 결과와 관련성이 될 수 있다.
Nova 임상은 germline BRCA 양성 코호트와 음성 코호트에 각각 할당했지만, FDA는 제줄라에게 모든 희망 라벨을 부여했다.
EP(Evaluate Pharma)에 따르면, 자문위의 한 가지 옵션은 제줄라의 유지 승인을 완전히 철회하는 것이 아니라 gBrca 변이 질병으로 제한하는 것일 수 있다.
린파자는 이 세팅에서 모든 지원 라벨을 자랑하고, 이는 두 연구의 2차 최종목표에서 전체 생존의 이익에 의해 뒷받침된다.
하지만, NOVA는 비교적 긴 기간 동안 PARP 억제제가 다수 세팅에 승인되었고, 결과적으로 광범위한 환자 탈퇴로 어려움이 있었다.
세 번째 Parp 억제제인 클로비스의 루브라카도 무진행 생존 이익만을 기반으로 난소암 유지에 사용할 수 있다.
또한, 제줄라와 린파자도 무진행 생존만으로 1차 라인 유지 적응증을 추가할 수 있다.
제줄라는 모든 지원 라벨을 자랑하지만, 린파자는 BRCA 양성, 혹은 아바스틴(Avastin)과 복합할 경우 HRD 양성 환자로 제한된다.
3개 PARP 억제제는 심하게 치료받은 난소암 환자에 대한 단일 표적 연구에서 완화율을 기준으로 완전 승인을 받았다.
하지만, 클로비스가 Ariel-4 연구에서 31%의 생존 손상을 보고한 후 지난 6월 루브라카의 임상을 중단했다.
린파자는 Solo-3 임상이 1.33의 위험률을 보였던 지난 8월 연구를 정리했고, GSK는 다른 PARP 억제제들의 전체 정보를 근거로 제줄라를 후기 라인 사용에서 철수시켰다.
전립선암에 대한 린파자의 광범위한 승인은 클로비스의 경쟁자인 루브라카에게 많은 희망을 주었다.
최근, 클로비스는 Triton-3 연구가 BRCA 양성 환자뿐만 아니라 BRCA 또는 ATM 변이를 가진 환자에서도 진행 없는 생존에 긍정적 결과를 보였다고 밝혔다.
루브라카는 BRCA나 ATM에 변이가 있는 전이성 거세 내성 전립선암(mCRPC) 환자에서 화학요법이나 2차 안드로겐 박탈요법에 비해 종양 진행이나 사망 위험을 39% 줄였다.
3상 TRITON3 임상은 안드로겐 수용체 차단제와 택산 기반 화학요법을 받은 환자에서 BRCA 변이 mCRPC에 대한 루브라카의 FDA 가속 승인을 위한 확증 연구이다.
클로비스는 2020년에 허가된 조건부 승인을 완전 승인으로 전환하고, 루브라카를 화학요법을 못한 mCRPC 환자들로 확대를 기대하고 있다.
린파자는 Brca가 분명히 더 광범위한 이익을 견인했고 ATM-변이 그룹이 대조군 코호트를 지지하는 위험 비율을 산출했음에도, ATM뿐만 아니라 BRCA 등 모든 HRR(homologous recombination repair) 변이를 가진 환자에게 승인되었다.
클로비스는 ATM 양성 전립선암에 대한 루브라카의 사용 확대를 모색하고 있다.
화이자는 3상 TALAPRO-2 임상의 초기 데이터에서 경구용 PARP 억제제 탈젠나(Talzenna, talazoparib)가 mCRPC 환자에서 1차 최종 목표에 도달했다고 보고했다.
또한, 탈젠나와 아스텔라스 파마의 안드로겐 수용체 억제제 엑스탄디(Xtandi, enzalutamide)와 복합으로 치료받은 환자도 엑스탄디와 위약을 받은 환자에 비해 방사선상 무진행 생존의 유의한 개선을 보였다.
TALAPRO-2는 750명의 환자와 380명의 HRR 유전자에 변이가 있는 남성 등 2개 mCRPC 환자 코호트로 구성된 무작위, 이중눈감림 임상시험이다.
mCRPC 진단을 받은 후 전신 치료를 받지 않은 환자가 대상이었다.
탈젠나+엑스탄디의 안전성은 각 약품의 알려진 안전성 프로파일과 일반적으로 일치했다.
화이자는 TALAPRO-2의 자세한 결과를 다가오는 의료 학술대회에서 발표할 예정이다.
화이자는 승인이 될 경우, 탈젠나+엑스탄디 복합은 mCRPC 환자의 새로운 표준요법이 될 수 있을 것으로 기대하고 있다.
이전 AZ/MSD의 린파자, GSK의 제줄라도 전립선암 임상에서 비슷한 긍정적 결과를 보였다.
두 약품도 각각 J&J의 안드로겐 수용체 자이티가(Zytiga)와 복합으로 사용됐다.
3상 PROpel 임상시험에서, 린파자+자이티가 복합은 자이티가 단독에 비해 진행 또는 사망의 위험을 34% 줄였다.
탈젠나는 2018년 미국 FDA에서 생식선 BRCA 변이, HER2 음성 진행성 유방암에 대해 승인됐다.
린파자는 같은 적응증에 PARP 계열에서 첫 승인됐다.
EP는 AZ/MSD의 린파자는 2028년에 55억 달러의 매출을 예상했고, 이 중 15억 달러가 전립선암에서 나올 것으로 추정했다.
루브라카의 전립선암 라벨은 7700만 달러 등 총 2.28억 달러의 매출을 예상했다.
AZ/MSD의 린파자는 자이티가(Zytiga) 혹은 엑스탄디(Xtandi) 치료 후 진행된 HRR 유전자 변이를 가진 이전 치료받은 mCRPC 환자의 더 광범위한 모집단에 대해 FDA에서 2020년 승인됐다.
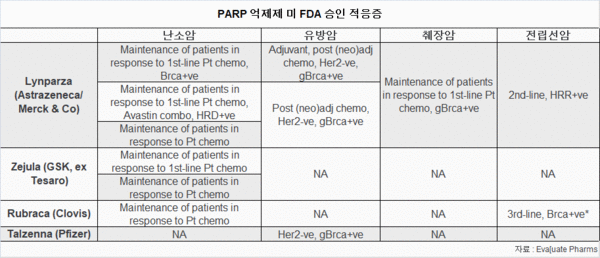
전체적으로, 린파자는 난소암 유지요법, 유방암, 췌장암 유지요법, 전립선암에 승인된 반면, 제줄라는 난소암 유지에만 FDA 승인을 받았다.
루브라카는 난소암 유지와 3차 라인 전립선암에 청신호를 받았고, 네 번째 PARP 억제제인 화이자의 탈젠나(Talzenna)는 유방암에 승인됐다.