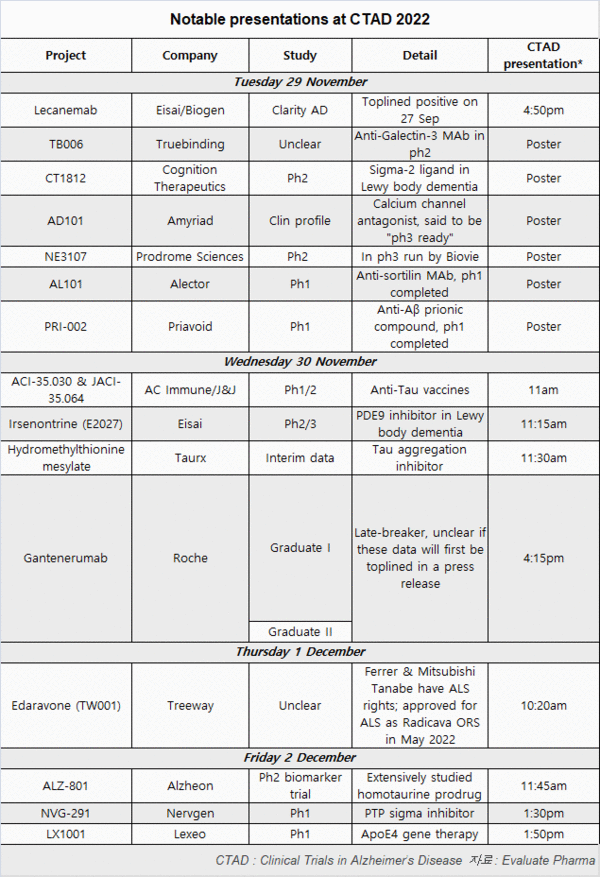
바이오젠/에자이 ‘레카네맙’ 초기 AD 3상 연구 성공
릴리‧로슈, 후보 약품 최종 단계 연구 주목 받아
에자이와 바이오젠의 임상 성공 소식으로 난치성 질환인 알츠하이머병 치료제를 개발 중인 다른 업체에 대한 기대감도 높아지고 있다.
바이오젠과 파트너 에자이는 초기 알츠하이머병(AD 치료를 위한 항아밀로이드 베타 프로토피브릴(protofibril) 항체 후보 레카네맙(BAN2401)에 대한 대규모 3상 Clarity AD 연구가 1차 목표를 충족했다고 밝혔다.
Clarity AD 연구는 뇌에서 아밀로이드 병리의 존재가 확인된 초기 AD와 경AD로 인한 경도 인지 손상의 치료에 레카네맙을 평가하고 있다.
연구는 질병과 관련된 임상적 감소에서 통계적으로 매우 유의미한 감소를 보였다고 회사 측은 밝혔다.
연구의 1차 최종목표는 치매 증상의 심각도를 측정하는 수치 척도인 CDR-SB(Clinical Dementia Rating-Sum of Boxes)이었다.
연구에서 초기 AD 환자에 대한 레카네맙의 치료군은 위약군에 비해 CDR-SB 척도의 임상 감소율 27% 감소시켜, 1차 최종목표에 도달했다.
또한 연구는 통계적으로 매우 유의미한 결과를 보여주는, 모든 주요 2차 최종목표를 충족했다.
항아밀로이드 항체와 관련된 뇌팽창 부작용인, 아밀로이드 관련 영상 이상(ARIA) 발생은 관리 예상 이내였다.
바이오젠/에자이는 이미 레카네맙을 미국 FDA에 승인을 신청해, 신속 검토 하에 있다.
FDA의 결정은 2023년 1월 6일로 예상된다.
에자이는 2023년 1분기 말까지 EU와 일본에서 규제 신청서를 제출할 계획이다.
바이오젠은 에자이와 협력으로 레카네맙을 개발했으며, 에자이는 임상 개발 및 규제 신청을 담당하고 있다.
두 회사는 다른 항아밀로이드 항체인 아두헬름(Aduhelm)을 2021년 6월 FDA의 승인을 받았지만, 의미 있는 매출을 올리지는 못했다.
보험등재 실패 등으로 바이오젠은 환자의 접근 프로그램을 관리하기 위한 최소한의 자원만 유지하면서 아두헬름의 마케팅을 실질적으로 중단했다.
아두헬름의 실패는 항아밀로이드 베타 항체의 매커니즘에 대한 의심을 불러일으켰다.
이런 항체는 뇌에서 Aβ 단백질의 비정상적인 축적을 제거하는 것을 목표로 한다.
이런 단백질의 축적은 알츠하이머병의 주요 원인 중 하나로 간주되고 있다.
바이오젠/에자이는 최신 레카네맙 Clarity AD 연구 결과가 아밀로이드 가설을 증명하고 있다고 주장했다.
로슈‧릴리 최종 단계 연구
로슈와 릴리 등 다른 대형 제약사들도 AD 적응증을 표적으로 하는 후보들을 개발하고 있다.
항아밀로이드 베타 항체를 타깃으로 하는, 이런 회사들의 알츠하이머병 후보들도 최종 단계 개발 혹은 검토 중에 있고 몇 달 안에 출시될 것으로 예상된다.
릴리의 도나네맙(donanemab)은 초기 AD 치료에 대해 가속 승인 경로에 따라 미국에서 우선 검토되고 있다.
도나네맙의 신속한 승인을 추구하는 릴리의 BLA는 중간 단계 TRAILBLAZER-ALZ의 임상 데이터를 기반으로 했다.
연구 데이터에서 도나네맙은 초기 증상적 AD 환자에서 위약군에 비해 질병 진행을 32%까지 유의한 감소를 보였다.
로슈의 AD 파이프라인 후보인 간테네루맙(gantenerumab)은 피하 투여로 개발된 항아밀로이드 베타 항체이다.
후보는 현재 중요 III상 GRADUATE 1, 2 연구에서 평가되고 있다.
로슈는 올해 안에 두 연구 톱라인 데이터를 예상하고 있다.
지난 10월, FDA는 간테네루맙을 AD에 획기적 치료제 지정(BTD)을 허가했다.
많은 실패에도 불구하고, 이런 많은 노력은 AD에 대한 새로운 치료제 욕구를 일부 충족할 수 있을 것으로 예상된다.
The Journal of Alzheimer's Association 5월호에 게재된 연구 결과에 따르면, 올해 1월 25일 기준 AD에 대해 172개 임상시험에 143개 후보 약품이 있다.
파이프라인에는 47개 3상 임상에서 31개 약품, 94개 2상 임상에서 82개 약품, 1상 31개 연구에서 30개 약품이 평가되고 있다.
질병 수정 치료제가 임상시험에 있는 전체 약물의 83.2%를 차지하고 있고, 증상적 인지 증진 치료는 임상시험의 약물의 9.8%, 신경정신적 증상 치료를 위한 약물은 6.9%를 차지하고 있다.
파이프라인에 있는 후보 약물의 37%는 다른 적응증에 대해 승인된 용도 재창출 약품이다.
현재 진행 중인 모든 임상시험의 등록요건을 충족시키기 위해서는 총 5만명 이상의 참가자가 필요하다.