혈액암 치료 단독그룹 임상 NO…무작위 연구 필요
FDA 자문위, 독성 및 생존 우려로 제한…‘자이델릭’ 등 4개 영향
혈액암에 대한 PI3K(phosphatidylinositol-3-kinase) 억제제 계열의 약품에 빨간 불이 켜졌다.
독성과 우려되는 환자 생존에 관한 데이터는 다양한 유형의 혈액암 치료에 사용되어 온 PI3K 억제제의 단일 그룹 임상 연구를 중단에 대한 미국 FDA 자문위원회 권고를 촉발했다.
대신, FDA 자문위는 안전 문제를 완화하기 위해 무작위 임상 시험의 사용을 권고했다.
21일(현지시각), FDA 종양약물 자문위는 PI3K 억제제의 향후 무작위 임상시험에 의해 지지되는 PI3K 억제제의 향후 승인을 요구하는 표결을 실시했다.
위원회는 16명이 찬성하고 1명이 기권으로 의결했다.
표결은 PI3K 억제제 약품 계열에서 생존과 독성 우려에 대한 3시간 동안의 강력한 토론 후에 이루어졌다.
4개 약품 표적
FDA 혈액학자들은 논의에 있는 4개 약품과 관련된 승인 이력을 제시했다.
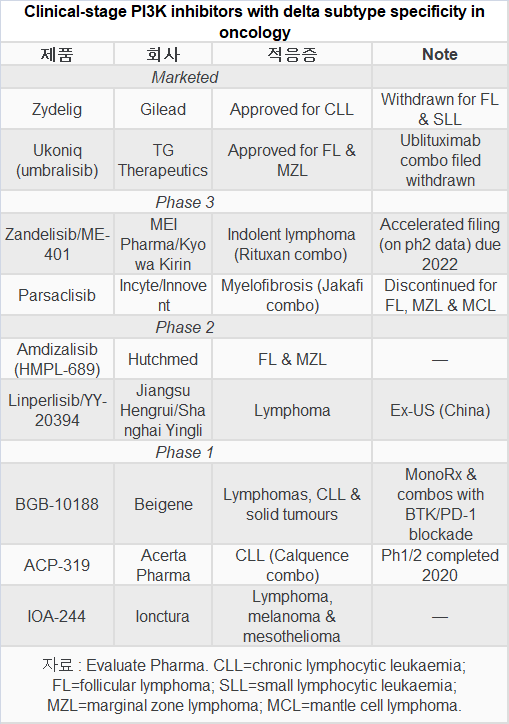
특정 종류의 암에 대해 시장에서 철수한 길리어드 사이언스의 자이델릭(Zydelig, idelalisib), 임상시험 동안 안전성 문제를 보인 바이엘의 알리코파(Aliqopa, copanlisib), 세큐라 바이오의 코픽트라(Copiktra, develisib), TG 테라퓨틱스의 유코닉(Ukoniq. umbralisib) 등 4개 승인된 약품이 대상이었다.
유방암에 승인된 PI3K 알파 특이 억제제인 노바티스의 피큐레이(Piqray)는 다른 활성 메커니즘으로 이번 조사에서 제외됐다.
안전성 우려는 PI3K 억제제 중 처음으로 시장에 진입한 자이델릭에서 제기되었다.
이 약품은 종양 감소 또는 질병 진행 데이터로 통해 만성 림프구 백혈병(CLL), 여포성 림프종(FL), 소림프구 림프종(SLL)에 승인됐다.
길리어드는 2016년 CLL 또는 무통성 비호지킨 림프종(iNHL)에서 3건의 무작위 임상시험을 중단했다.
더 높은 사망률은 지이델릭이 종양 통제에 덜 효과적이어서가 아니라 치명적인 감염에 의해 발생했다고 FDA는 지적했다.
지난 2월, 길리어드는 시판 후 임상에 등록이 느리다며 FL과 SLL에 자이델릭을 자진 철수시켰다.
바이엘의 알리코파는 지난해 2차 라인 iNHL의 3상 CHRONOS-3 임상에서 승리를 거둔 것으로 나타났다.
연구에서 로슈의 리툭산(Rituxan)과 알리코파의 복합은 질병의 진행이나 사망 위험을 48% 줄였다.
알리코파 그룹은 더 많은 심각한 부작용과 더 많은 환자들의 치료 중단을 보였지만, 당시 바이엘은 대부분의 이런 문제들은 다룰 수 있다고 밝혔다.
또한 중간 분석에서 약품은 사망 위험을 13% 줄였다.
하지만, FDA는 리툭산 단독그룹의 환자가 알리코파+리툭산 콤보 환자보다 더 오래 살기 시작하면서 두 치료 그룹 사이의 생존 곡선이 약 2년에서 역전된 것을 보인 우려되는 추세에 주목했다.
FDA는 극소수의 환자만이 사망했다는 사실을 감안할 때 데이터가 너무 초기라는 것을 인정했지만, 환자들에게 잠재적인 위험을 배제할 수 없다고 지적했다.
작년 12월, 바이엘은 자발적으로 알리코파+리툭산 복합요법의 신청을 철회했다.
회사는 추가 분석 후 치료제의 재제출 가능성을 재평가할 계획이다.
이는 자이델릭과 알리코파만이 직면한 불확실성이 아니다.
세큐라 바이오의 코픽트라도 노바티스의 항CD20 항체 아제라(Arzerra)와 비교해 이전 치료받은 CLL/SLL에서 생존 이익을 입증하지 못했다.
또한, TG 테라퓨틱스는 시험 중인 CD20 약품과 유코닉(Ukoniq)의 복합에 대해 긍정적인 전체 생존 이익을 보여주지 못했다.
회사는 복합요법 개발을 중단했고, 두 가지 iNHL 하위유형에서 유코닉 단독요법을 마케팅하고 있다.
FDA는 6건의 무작위 임상시험에서 4개 승인된 PI3K 억제제가 독성 때문에 혈액암 환자의 생명을 단축시킬 수 있을 시사하는 추세를 보였다고 밝혔다.
자문위는 이런 제품 모두가 효과적이지만, 매우 우려되는 안정성 프로파일을 가지고 있다고 밝혔다.
FDA 혈액학자인 Nicholas Richardson 박사는 이 계열에서 단독그룹 임상의 사용하는 것의 한계를 것의 한계를 지적했다.
그는 “단독그룹시험에서는 약품의 효능과 안전성의 균형을 맞추기가 어려울 수 있다. 무작위 임상이 일상적인 효과와 치료를 입증하는 선호되는 접근 방식”이라고 말했다.
리처드슨은 전체 생존은 무작위 임상시험에서만 평가될 수 있는 임상적 이익의 객관적인 척도라고 덧붙였다.