유전자 편집 등 다양한 메커니즘과 기술 출현 기대
드문 혈액 질환인 겸상 적혈구 질환을 타깃으로 유전자 편집 등 새로운 접근이 다가오고 있다.
현재, 겸상 적혈구 치료제 시장은 GBT(Global Blood Therapeutics의 옥스브리타( Oxbryta)와 노바티스의 아닥베오(Adakveo)가 양분하고 있다.
EP(Evaluate Pharma)에 따르면, 올해 옥스브리타와 아닥베오의 매출은 각각 3.33억 달러, 2.59억 달러로 예상되고 있다.
두 약품의 독점은 오랫동안 지속되지 않을 수 있다.
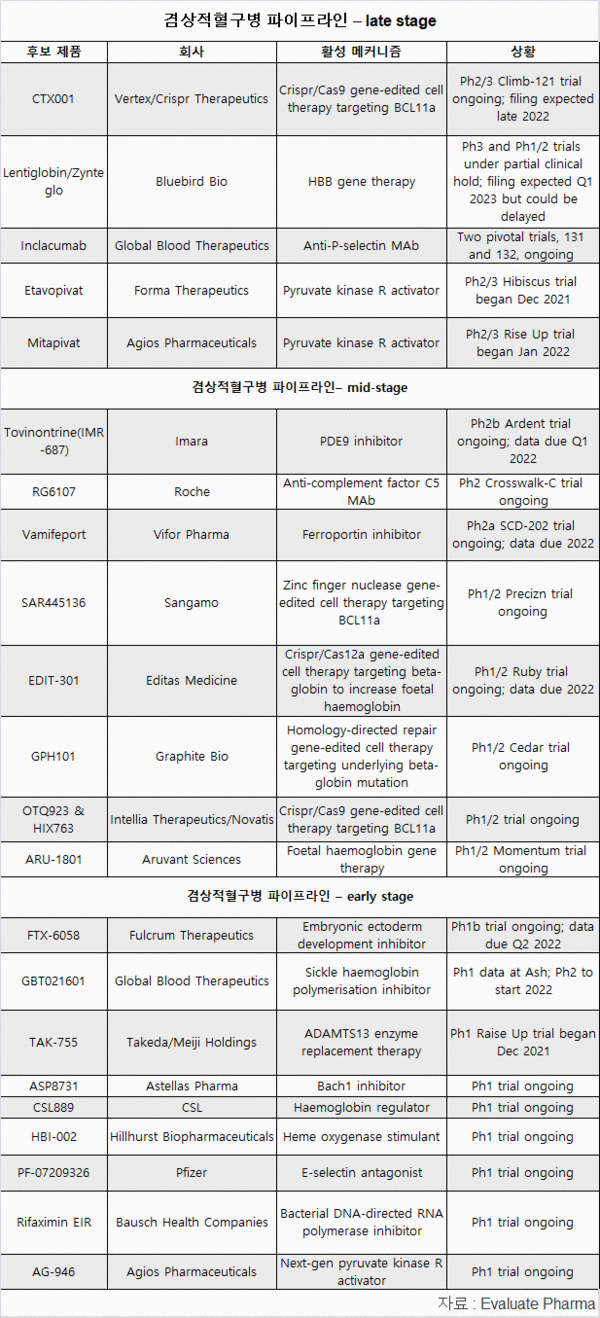
크리스퍼 테라퓨틱스(Crispr Therapeutics)의 유전자 편집 CTX001의 승인 신청이 임박했고, 최근 2개 후보가 최종단계 임상시험을 시작했다.
BCL11a를 타깃으로 한 크리스프/카스9(Crispr/Cas9) 유전자 편집 세포 치료제 CTX001의 2/3상 시험이 완전 등록됐고, 크리스퍼 테라퓨틱스와 파트너 버텍스(Vertex)는 올해 겸상 적혈구와 베타 지중해빈혈에 신청을 계획하고 있다.
임상시험은 중증질환이 있는 12~35세 사이의 45명 환자를 대상으로 CTX001의 단독요법을 평가하고 있다.
지난해 6월 유럽혈액학회(EHA) 미팅에서, CTX001을 받은 환자 7명이 혈관 폐쇄 위기(VOC)없이 유지했다.
EP는 옥스브리타에 이어 두 번째인, CTX001의 2026년 매출 전망치는 10억 달러를 약간 넘을 것으로 예상하고 있다.
CTX001과 같은 유전자 편집 약품은 시판되는 제품과 확실하게 차별화될 것이지만, 새로운 기술의 위험성은 FDA가 지난해 블루버드의 렌티글로빈(Lentiglobin) 유전자 치료제에 대해 부분 임상 보류에서 설명되고 있다.
GBT의 두 번째 주사제인 인클라쿠맙(inclacumab)은 아닥베오와 메커니즘을 공유해, 더 안전한 지역에 있다.
최종 단계 파이프라인에 PKR(pyruvate kinase R) 활성제가 있다.
포마(Forma)의 에타보피바트(etavopivat)는 1상 임상에서 아지오스(Agios)의 미타피바트(mitapivat)보다 약간 우수함 보였고, 회사는 신속승인을 기대하고 있다.
각각의 2/3상 임상은 헤모글로빈 반응과 VOC의 복합에 초점을 맞춘, 유사한 효능 최종목표를 가지고 있다.
미타피바트는 하루에 두 번 투여하는 반면, 에타보피바트는 1회 투여로 더 경쟁 우위가 있다.
아지오스는 겸상적혈구 프로그램의 1상 임상에서 AG-946을 평가하고 있다.
올해 초기 및 중간 단계 임상에서 많은 데이터가 나올 것으로 예상돼, 3상 파이프라인은 곧 증가할 수 있다.
이마라(Imara)의 토비논트린(tovinontrine)은 2b Ardent 임상을 진행 중이지만, 긍정적 3상 임상이 여전히 필요하다는 입장이다.
다른 크리스프의 후보인, 에디타스(Editas)의 EDIT-301도 한 걸음 더 나아갈 준비를 하고 있다.
Ruby 임상시험의 첫 번째 환자는 아직 투약되지 않았다.
2개 다른 유전자 편집 접근이 2상에 있다.
지난 1월, 사노피는 아연 핑거 기반의 SAR445136에 대한 권리를 상가모(Sangamo)에게 반환했다.
노바티스의 1/2상 연구는 2개 게놈 편집, 자가 세포제품인, 단독과 복합으로, OTQ923과 HIX763을 평가하고 있다.
풀크룸 테라퓨틱스(Fulcrum Therapeutics)는 경구 배아외배엽 발단 억제제인 FTX-6058을 1상에서 평가하고 있다.
소규모 1b 임상은 약물의 안전성과 혈장 농도에 초점을 맞추고 있지만, 태아 헤모글로빈 수치와 다른 겸상적혈구 바이오마커는 2차 결과이다.
앞으로 몇 개월 동안, 겸상적혈구 질환에 대한 다양한 메커니즘과 기술을 검증하는 데이터가 나올 것으로 예상된다.