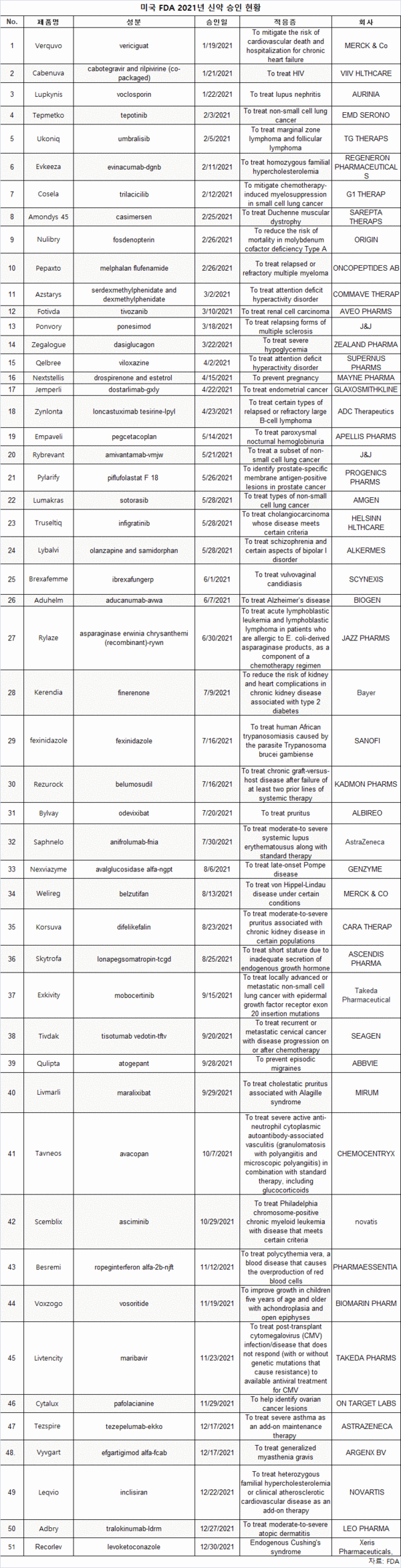
51개 약품 청신호 보내…암 적응증 15개 최다, 빅 파마, 저조
작년 미국 FDA는 코로나19 팬데믹 중에도 51개 신약을 승인했지만, 빅 파마의 실적은 저조한 것으로 파악됐다.
FDA의 신약 승인 데이터베이스를 보면, 새로운 적응증에 대해 이전 승인된 약품을 포함하지 않고, 새로운 화학물질에 대해서만 승인된 신약은 51개로 2020년 53개, 2019년 48개와 비슷했다.
반면, 매출 기준으로 톱 20대 제약사의 경우, 1개 이상 신약을 승인받은 업체는 9곳에 불과했다.
특히 6개사가 2개 신약, 나머지 3개사는 1개 신약만을 허가받았다.
적응증 별로는 암이 15개로 가장 많았다.
한 적응증에 첫 승인, 미충족 의료 욕구의 충족, 질병에 대한 약품 계열에서 첫 승인 등의 측면에서, 작년 가장 주목을 받은 승인 제품들이 있다.
화이자/바이오엔텍, 모더나의 코로나19 백신의 승인은 팬데믹의 전환점이 될 수 있다는 기대를 주었다.
화이자의 코미나티(Comirnaty)는 작년 8월말 18세 이상에 대해 완전 승인을 받은 반면, 모더나의 백신은 긴급사용을 허가 받았다.
실제 신약 승인은 화이자의 백신이다.
바이오젠의 아두헬름(Aduhelm, aducanumab)은 약 20년 만에 알츠하이머병 치료에 승인된 첫 약품으로 큰 관심을 받았다.
이 약품은 수십억 달러의 매출이 기대됐지만, 지금까지 예상에 미치지 못했다.
승인 이전부터 논란으로, 아두헬름은 2021년 3분기에 예상치의 1/3 수준에 불과한 30만 달러의 매출을 기록했다.
아두헬름의 승인은 미 FDA 자문위원회, 의회, 의사, 시민단체 등의 비판을 받았다.
2021년 1월, 화이자의 잘코리(Xalkori, crizotinib)를 ALK(anaplastic lymphoma kinase) 양성인 재발/난치성 전신 역형성 대세포 림프종(ALCL)이 있는 1세 이상 환자에게 승인됐다.
ALCL은 젊은 사람들의 비호지킨 림프종(NHL)의 약 3분의 1을 차지하는 비호지킨 림프종의 드문 유형이다.
젊은 사람들의 ALCL 사례의 약 90%가 ALC 양성이다.
성인 환자에게는 이미 수년 전 승인되었지만, ALC 양성 젊은 환자에게는 첫 의미 있는 새로운 치료 옵션이 됐다.
오리니아 파마슈티컬스(Aurinia Pharmaceuticals)는 만성적이고 복잡한 자가면역질환인 전신 홍반성 루푸스(SLE)의 심각한 진행인 루푸스 신염에 첫 경구 약품인 루프키니스(Lupkynis, voclosporin)를 승인받았다,
지난 3월 FDA는 전신성 경화증 관련 간질성 폐질환(SSC-ILD)을 가진 성인의 폐 기능 저하율을 늦추는 데 제넨텍의 악템라(Actemra, tocilizumab)를 승인했다.
이런 적응증에 대해 FDA가 승인한 첫 바이오로직이었다.
작년 9월, 애브비는 발작적 편두통 예방에 경구용 큐립타(Qulipta, atogepant)를 승인받았다.
이 약품은 이런 적응증에 특별히 개발된 첫 CGRP(calcitonin gene-related peptide) 수용체 길항제이다.
노보 노디스크의 위고비(Wegovy, once-weekly semaglutide 2.4 mg self-injection)는 비만 치료에 승인된 최초이자 유일한 주 1회 GLP-1 수용체 작용제이다.
이 약품은 오젬픽(Ozempic)이란 브랜드로 2형 당뇨병을 치료에 사용되고 있다.
작년 11월, FDA는 일부 항바이러스제로 치료가 어려운 이식 후 사이토메갈로바이러스(CMV) 감염이 있는 최소 12kg 체중인 12세 이상 성인과 어린이에게 다케다제약의 리브텐시티(Livtencity, maribavir)의 사용을 허가했다.
이 약물은 새로운 성분(NME)인 생물학적으로 이용 가능한 항CMV 화합물이다.
이밖에도 치료 패러다임의 변화를 가져올 일부 약품들이 승인됐다.