AZ ‘사프넬로’ 10여년 만에 청신호…GSK ‘벤리스타’에 도전
아스트라제네카(AZ)가 10여년 만에 새로운 계열의 전신홍반성난창(루푸스) 치료제를 미국에서 승인받아 리더인 GSK의 벤리스타(Benlysta)에 도전하고 있다.
AZ는 표준요법을 받고 있는 중등도에서 중증 루푸스(SLE) 성인 환자의 치료에 사프넬로(Saphnelo, anifrolumab-fnia)를 미국 FDA에서 2일(현지시각) 승인을 받았다고 밝혔다.
사프넬로는 첫 1형 인터페론 수용체 길항제이고 10여년에서 루푸스에 대해 승인된 유일한 새로운 치료제이다.
승인은 최종단계 TULIP-1, 2 연구와 2상 MUSE 연구 등 임상 개발 프로그램을 근거로 했다.
연구 결과, 정맥 주사제 사프넬로 치료를 받는 환자들은 피부와 관절 등 장기 시스템 전반에서 전체 질병 활동 감소를 경험했고, 표준요법을 받고 있는 두 그룹과 함께, 위약군에 비해 경구 코르티코스테로이드의 필요성을 지속적으로 감소시켰다.
하지만, 연구 데이터는 복합적이었다.
사프넬로는 3상 TULIP 1 임상시험에서 최종목표에 도달하지 못했지만, 평가는 스테로이드 섭취 감소와 피부 루푸스 효과 개선 등 유의한 개선을 입증했다.
루푸스 약품 효과는 입증하기 어렵기로 악명 높다.
임상 목표는 TULIP-2로 변경했고, 1차 최종목표를 달성했다.
치료 시작 2개월에서 질병 활동 감소를 보였다.
AZ는 2004년 메다렉스와 독점 계약을 통해 MEDI-546으로 알려진 사프넬로에 대한 글로벌 권리를 취득했다.
이후, 2009년 메디렉스를 인수한 BMS에게 사프넬로 판매에 대한 로열티를 지불해야 한다.
사프넬로는 현재 EU와 일본에서 루프스에 대해 검토 중이다.
AZ는 루푸스 신염, 피부 홍반성 낭창(CLE)과 근염에 추가 후기 연구의 계획과 함께, 3상 임사에서 피하 제형을 연구하고 있다.
경쟁
GSK는 2011년 B세포 자극인자를 억제하는 벤리스타(Benlysta)를 미국 FDA에서 승인으로 50년 가까이 지속된 이 분야의 침체를 종식시켰다.
2011년 출시 이후 판매 실적을 저조했지만, 올해 블록버스터가 될 것으로 예상된다.
GSK는 올해 상반기 벤리스타의 매출은 3.92억 파운드로 연간 20% 급증했다고 보고했다.
성장은 작년 하반기 미국과 일본에서 출시한 루푸스 신염의 영향 등이 견인했다.
EP(Evaluate Pharma)는 2026년까지 벤리스타의 매출은 15억 달러에 이를 것으로 추정했다.
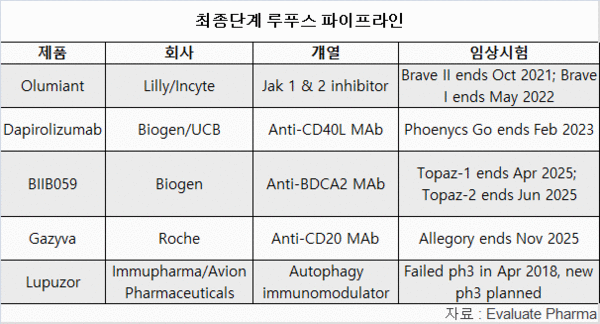
최종 단계 파이프라인을 보면, AZ는 다른 경쟁자들이 너무 많지 않다.
GSK의 벤리스타가 오랫동안 사프넬로의 유일한 경쟁자가 아닐 수 있다.
바이오젠은 최근 두 번째 경쟁자 BIIB059의 중요 개발을 시작했다.
로슈는 루푸스 신염에 가지바(Gazyva)를 평가하고 있다.
이전 중대한 실패를 맛본 임뮤파마는 파트너인 에비온(Avion)의 자금 지원을 받아 두 번째 3상에서 루푸조르(Lupuzor)를 테스팅할 예정이다.
릴리와 인사이트는 3상 Brave I, II 임상시험에서 루푸스에 대해 JAK 억제제 올루미안트(Olumiant)를 테스트하고 있다.
AZ는 미국에서 30만 명 이상이 루푸스에 영향을 받고 있는 것을 감안할 때, 사프넬로는 블록버스터 잠재력이 있다고 주장했다.
EP는 사프넬로의 매출은 2026년까지 4억 8800만 달러에 이를 것으로 예상했다.
AZ의 사프넬로의 상업화 성공은 루프스로 인한 신장 염증인 루푸스 신염으로 잠재적 확대에서 올 수 있다.
작년 12월 벤리스타는 활성 루푸스 신장염 환자에 대해 FDA의 승인을 받은 첫 번째 약이 됐고, 한 달 뒤인 1월에 워리니아(Aurinia)의 루프키니스(Lupkynis) 승인으로 빠르게 뒤를 따랐다.
AZ는 최근 사프넬로 고용량이 루푸스 신염에서 일부 개선을 보인 2상 Tulip-LN 임상시험을 완료했다.

