中 임상시험 95% 차지…대다수 초기 단계 연구
컨설팅업체인 글로벌데이터에 따르면 APAC에 소재한 기업들이 개발 중에 있는 CAR-T(chimeric antigen receptor) 세포 치료제는 현재 445개가 있다.
진행되는 연구와 암 바이오로직의 이해 증가로, 새로운 치료제들은 글로벌 시장을 더 경쟁적이고 비용 효과적으로 만들 수 있다.세포 양식의 대다수는 임상적 개발의 초기 단계에 있다.
급성 림프구 백혈병, B 세포 급성 림프구 백혈병, 난치성 다발성골수종이 APAC에서 개발 중에 있는 CAR-T 치료제의 3가지 주요 적응증이다.암은 인구 고령화, 경제 발전과 관련된 생활습관 변화와 역학 변화 때문에 APAC 지역에서 심각한 건강 우려가 되고 있다.
CAR-T 치료제의 임상적 결과는 인상적이고 재발/난치성 환자에서 주목할 결과를 보였다.하지만, 효능의 증거는 더 많은 임상을 진행을 통해 여전히 수집되고 있다.
2019년. 일본 후생노동성(MHLW)은 급성 림프구 백혈병과 광범위 대 B세포 림프종 치료에 첫 CAR-T 치료제 킴리아(Kymriah (tisagenlecleucel)를 승인했다.이 약품은 2018년 호주에서 급성 림프구 백혈병 치료에 청신호를 받았다.
글로벌데이터에 따르면, 2월10일 기준으로 APAC 지역에서 369건의 임상시험이 진행 중에 있다.이런 임상의 대부분은 임상 I 상이고 이어 임상 II/II이다.
CAR-T 양식은 여전히 임상 평가 단계에 있고 신세대 항암제로서 성공하기 위해서는 상당한 양의 데이터 평가가 필요하다.지금까지 중국이 APAC 지역 전체 임상시험의 약 95%를 차지해 CAR-T 세포 임상시험에서 선두를 달리고 있다.
중국이 CAR-T 세포치료 개발을 주도하고 있지만, 대부분의 프로그램이 개발 초기 단계에 있기 때문에 중국에서 CAR-T 요법의 승인은 상당한 시간이 걸릴 것으로 보인다.미국 임상 등록기관인 ClinicalTrials.gov를 보면, 전 세계에서 CAR-T 치료제 임상은 498건이 등록돼 있다.
이 중 APAC 지역은 중국이 266건, 호주 10건, 일본 7건, 한국과 태국이 각각 2건 등 총 275건이 등록돼 있다.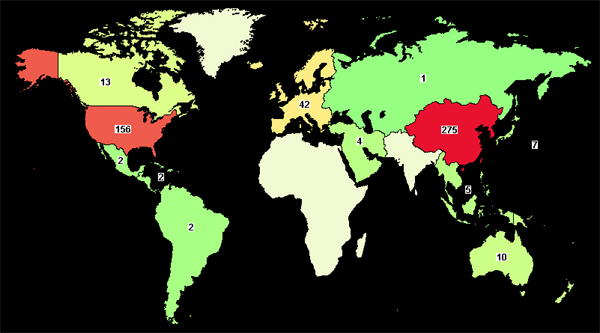
CAR-T 임상시험 등록 수 자료:ClinicalTrials.gov
고재구 기자
news@pharmstoday.com

