작년 16개로 승인율 26%…AZ, 5년간 최다 승인
이는 53개 기업이 61개 약품을 허가받았다.
화이자 4개, 어레이(Array), 아스트라제네카(AZ), 릴리, 시오노기, 샤이어가 각각 2개 등 6개 업체만이 다수 승인을 받았다.16개 신약(New Molecular Entities)으로 빅 파마의 승인 비율은 26%에 머물렀다.
이는 지난 10년간 35%~40%와 비교해 하락했다.이전 승인을 받지 못한 기업이 28개(60%) 등 중소기업이 47개를 승인받았다.
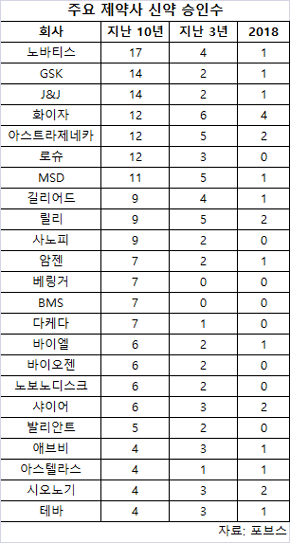
AZ는 9개 신약을 승인받아 최다를 기록했다.
2014년 회사는 항당뇨병제 파시가(Farxiga), 변비약 모반틱(Movantik), 항암제 린파자(Lynparza)를 FDA에서 청신호를 받았다.2015년은 폐암 치료제 타그리소(Tagrisso), 2017년은 항암제 임핀지(Imfinzi), 림프종 치료제 칼퀀스(Calquence), 항천식제 파센나(Fasenra)를 승인받았다.
작년은 고칼륨혈증 약 로켈마(Lokelma), 털세포 백혈병약 루목시티(Lumoxiti)를 허가받았다.릴리는 이 기간 8개 신약의 OK를 받았다.
2014년 항암제 사이람자(Cyramza)와 항당뇨병제 트루리시티(Trulicity), 2015년 폐암 치료제 포트라자(Portrazza)를 FDA에서 청신호를 받았다.2016년은 건선 관절염에 탈츠(Taltz), 연조직 육종에 라트루보(Lartruvo), 2017년은 유방암 치료제 버제니오(Verzenio)를 승인받았다.
2018년은 류마티스 관절염과 편두통 치료에 각각 올루미안트(Olumiant), 엠갈리티(Emgality)를 허가받았다.MSD는 5년간 7개 신약을 승인받았다.
2014년 수면제 벨솜라(Belsomra)와 항암제 키트루다(Keytruda), 2016년 C형 간염제 제파티어(Zepatier), 항생제 진플라바(Zinplava)에 대해 FDA에서 청신호를 보냈다.FDA는 2017년 사이토메갈로 바이러스 예방약 프리비미스(Prevymis)와 항당뇨병제 스테글러트로(Steglatro), 2018년 HIV 약품 피펠트로(Pifeltro)를 승인했다.
로슈, 길리어드 사이언스, 노바티스는 2014~2018년까지 각각 6개 신약을 승인받았다.로슈는 에스브리에트(Esbriet), 코텔릭(Cotellic), 티쎈트릭(Tecentriq), 오크레부스(Ocrevus), 헴리브라(Hemlibra), 졸플루자(Xofluza), 알레센사(Alecensa)를 5년간 승인받았다.
길리어드는 자이델릭(Zydelig), 하보니(Harvoni), 젠보야(Genvoya), 입클루사(Epclusa), 보세비(Vosevi), 빅타비(Biktarvy)를 FDA에서 청신호를 받았다.노바티스는 지카디아(Zykadia), 코센틱스(Cosentyx), 파리닥(Farydak), 엔트레스토(Entresto), 키스콸리(Kisqali), 리답트(Rydapt)를 허가받았다.
이밖에 엘러간, J&J, 화이자는 5년간 각각 5개 신약을 승인받았다.애브비, 암젠, 베링거인겔하임은 2014~2018년 사이에 각각 4개 신약을 허가 받았다.

