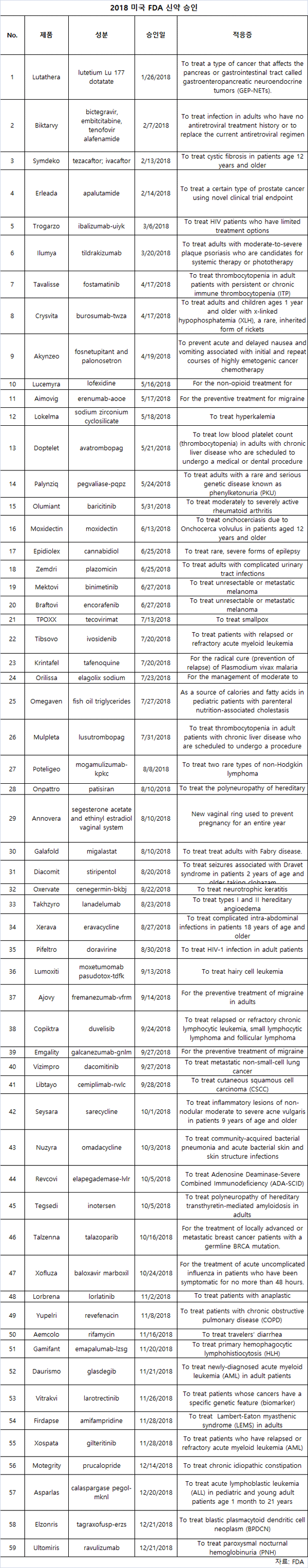
대마, 편두통, 유전자 침묵 등 59개 승인
2018년 더 적은 바이오로직 약품이 통과됐지만 미국 FDA는 지난 4년간 최다인 59개 신약을 승인했다.
전체적으로 FDA는 화학 성분을 사용하는 필수 의약품인 50개 NME(new molecular entities)에 청신호를 보냈다.이 중 17개는 BLA(biological license applications)를 승인했다.
NME 승인은 연간 28% 이상 증가한 반면 BLA 승인은 약 23% 감소했다.또한 일부 신약은 질병 치료의 새로운 방식이었다.
주목할 제품은 알니람 파마슈티컬의 유전성 ATTR 아밀로이드증에 첫 RNAi 약품 온파트로(Onpattro), 아이오니스 파마슈티컬/악세라 테라퓨틱스의 텍세디(Tegsedi) 등 유전자 침묵 약품이다.GW 파마슈티컬의 에피디올렉스(Epidiolex)는 어린이의 두 가지 유형의 간질 치료제인 첫 대마초 기반 약품으로 승인됐다.
FDA는 CGRP 계열의 편두통 예방에 3개 약품을 허가했다.암젠, 테바, 릴리의 편두 예방에 3개 CGRP 억제제와 함께 아지오스 파마의 급성 림프구 백혈병에 IDH1 억제제 팁소보(Tibsovo, ivosidenib), 아스트라제네카의 HCL(hairy cell leukaemia)에 CD22 유도 사이토톡신 루목시티(Lumoxiti, moxetumomab pasudotox), 타이메드 바이오록직스의 내성 HIV 감염에 대한 CD4 결합 항체 트로가르조(Trogarzo, ibalizumab) 등 새로운 메커니즘 활성을 가진 많은 약품이 있다.
버텍스 파마슈티컬은 심데코(Symdeko)를 새로운 낭포성 섬유증 치료에 추가했다.심데코는 테자캅토(tezacaftor)와 칼리테코(Kalydeco, Ivacaftor)의 복합제이다.
바이오로직으로는 포톨라 파마슈티컬이 안덱사(Andexxa)란 항응고제를 두 번째 청신호를 받았다.종양은 작년 17개 신약을 승인받아 큰 주제임을 입증했다.
FDA가 승인한 항암제 중 록소 온콜로지와 바이엘의 비트락비(Vitrakvi)가 특별하다.이는 특정 유전변이와 관련된 암을 치료하고 정밀 의학 약품에 속한다.
어레이 바이오파마는 2개 흑색종 치료제를 승인받았다.혈액암도 백혈병 치료에 6개가 승인돼 관심 분야였다.
2곳의 회사는 폐암, 다른 하나는 유방암 약품을 각각 승인받았다.작년 FDA에서 승인된 신약의 절반 이상이 희귀질환 치료제였다.
알렉션은 드물고 치명적 혈액질환인 PHN(paroxysmal nocturnal hemoglobinuria) 치료제 울토미리스(Ultomiris, ravulizumab)를 12월 말에 허가받았다.이 제품은 8주마다 투여하는 반면 기존 약품은 2주마다 주어야 한다.
스템라인 테라퓨틱스는 희귀암 BPDCN(blastic plasmacytoid dendritic cell neoplasm)에 엘존리스(Elzonris, tagraxofusp)을 허가받았다.카탈리스트 파마의 LEMS(Lambert-Eaton myasthenic syndrome) 치료에 피답세(Firdapse, amifampridine), 노브임뮨의 원발성 HLH(hemophagocytic lymphohistiocytosis) 치료제 가미판트(Gamifant, emapalumab), 레제너론/사노피의 CSCC(cutaneous squamous cell carcinoma) 치료에 리브타요(Libtayo, cemiplimab), SIGA 테크놀로지의 천연두 치료제 티폭스(TPOXX, tecovirimat) 등은 FDA에서 첫 승인됐다.
이밖에 많은 제네릭과 일부 바이오시밀러 약품이 승인돼 치열한 경쟁이 예상된다.