바이오젠, ‘뉴시너센’ 내년 승인 예상…아벡시스 등 추격 치열
바이오텍인 아벡시스(Avexis) 등이 이런 희귀질환에 대한 인상적인 데이터의 공개로 경쟁 대열에 뛰어들어 아이노니스 등과 개발 경주를 하고 있다.
척수성근위축증(SMA)은 근육 운동의 통제에 영향을 주는 유전질환이다.이는 척수에 운동신경세포란 특수 신경세포와 뇌간이란 척수와 연결된 뇌의 일부 상실의 원인이다.
SMA는 삼기기, 호흡 등 기본 과제의 수행을 어렵게 하고 마비를 유도할 수 있다.SMA의 가장 심각한 유형은 SMA 환자의 90%가 2세 전에 사망 혹은 영구 호흡 장치가 필요하게 할 수 있는 1형(Type 1)으로 분류된다.
베르드니히-호프만병이란 1형은 출생 첫 6개월 이내에 출현하는 가장 심각하다.2형 환자들은 걷을 수 없고 3형은 나중에 걷을 수 없고 4형은 성인기에 발병하는 가장 덜 심각하다.
SMN1 유전자의 부재 혹은 결함 때문에 SMN 단백질의 부족한 생성은 SMA 1형 원인이다.결손된 단백질은 근육 등 주요 조직에 엄청난 손상 원으로 운동 신경세포의 사망을 유도한다.
유망한 임상 데이터바이오젠과 파트너인 아이오니스는 스핀라자(Spinraza)로 알려진 뉴시너센(nusinersen)에 대한 다른 최종단계 임상에서 긍정적 데이터를 최근 발표했다.
학수고대하던 Cherish 임상 3상 연구에서 2형 SMA 어린이 환자들이 운동기능에서 통계적으로 유의미한 개선을 보였다.
걸을 수 없는 126명 환자에 대한 15개월 연구에서 점수 시스템을 통해 수용된 의학적 범위로 측정해 기준부터 치료 15개월까지 스핀라자로 치료받은 어린이들은 평균 4 포인터 개선을 보인 반면 치료 받지 않은 그룹은 평균 1.9점 감소한 것으로 나타났다.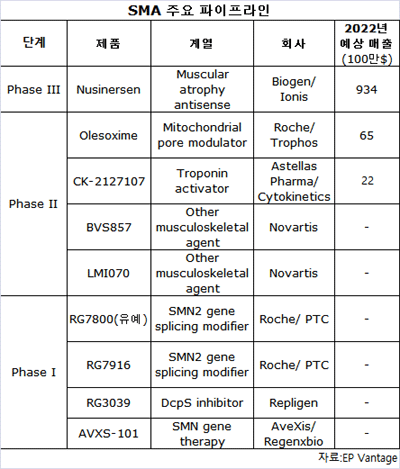
회사는 Nurture 임상의 데이터도 공개했다.
이는 6주 전에 첫 용량을 받은 1형 SMC로 진단된 전 증상 환자가 대상이었다.연구결과 뉴시너센 치료 그룹은 예상된 나이에 이동 단계에 도달했다.
후에 침습한 2, 3형 환자에 대한 임상 2상에서 3년 이상동안 이동 기능과 6분 걷기에서 지속된 개선을 보였다.바이오젠은 9월말 승인을 신청했고 최종 결정은 내년 3, 4월로 예상된다.
월 스트리트는 뉴시너센의 2025년 연 최고 매출은 17억달러에 이를 것으로 추정했다.로슈의 파트너인 아벡시스의 AVXS-101 약물은 결함 SMN1 유전자를 표적화로 근육 퇴행을 중단토록 기획됐다.
약물은 효율적인 질병 치료에 도움이 되는 운동 신경세포의 효과적 표적을 용이하게 한다.최근 발표한 연구에서 환자의 2/3가 목적 치료 용량으로 코호트2(Cohort 2)에서 지원없이 앉을 수 있다고 보고했다.
또한 12명 환자 중 11명이 머리를 통제했고 12명 중 7명은 완전히 뒹굴었고 11명은 지원으로 앉을 수 있었다.2명 환자는 치료 후 지원없이 걸을 수 있다고 보고했다.
로슈는 작년 올레속심(olesoxime)이란 후보약물을 트로포스로부터 라이선싱해 171명 환자를 대상으로 임상 2상을 시작했다.최근 RG7916와 복합으로 2, 3형 환자 186명을 대상으로 Sunfish란 두 번째 주요 연구를 시작했다.
RG7916은 PTC 테라퓨틱스와 협력으로 얻은 SMN2 유전자 스플리싱 변경자이다.경쟁사인 노바티스도 후발이지만 이 분야에 발을 담그고 있다.
임상 2상 중인 LM1070와 BVS857 등 임상 I/II에 있는 2개 후보가 있다.바이오젠과 아이오니스는 아벡시스와 PTC를 앞서 SMA의 첫 치료제를 처음으로 시장에 내놓을 것으로 예상된다.

