백신, 진단 테스트는 유럽 최다…美, 3위 차지
신종 코로나바이러스 감염증(코로나19) 팬데믹으로 많은 제약과 바이오텍 기업들이 치료제, 백신, 진단 테스트의 개발을 경주하고 있다.
7일 기준으로 전 세계에서 140만 명 이상 확진과 8만여 명이 사망한 코로나19에 대한 치료 임상은 중국과 유럽이 주도하고 있다.
미국 임상등록 기관인 ClinicalTrials.gov에 따르면, 임상 수에서 중국이 62건으로 가장 많았고 이어 유럽이 53건, 미국이 32건 등이다.다른 국가와 지역으로는 캐나다 12건, 중동 6건, 동남아시아 5건, 호주 4건, 아프리카와 멕시코가 각각 2건, 인도 1건 등이다.
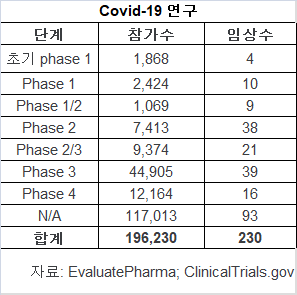
일부 임상시험의 경우, 지역이 등록되지 않았다.
총 임상 건수는 230건이 보고됐다.
백신 임상의 경우, 유럽이 7건으로 선두에 있고 이어 중국과 미국이 각각 6건과 4건이었다.
백신 임상은 총 23건이 보고됐다.
이 중 중국 우한에서 1건만이 진행 중에 있고 9건은 모집을 하고 있다.
진단 테스트와 관련된 임상의 경우, ClinicalTrials.gov는 총 118건을 보고했다.유럽이 36건으로 주도하고 있고 이어 중국이 25건, 미국이 19건, 캐나다가 4건으로 뒤를 잇고 있다.
하지만 임상실험에서 치료제, 백신, 진단 테스트의 수는 전체를 포함하지 않는다.많은 바이오파마 기업과 학술 연구소들이 코로나19 전투에 적극적으로 참여하고 있지만 아직 임상실험을 준비하지 못하고 있다.
FDA는 비상사용 허가(EUA) 신철을 제출할 계획에 있는 240개 이상 진단 개발자들과 협력하고 있다.또한 FDA는 가능한 조기에 회복된 코로나19 환자의 혈액에서 추출한 2개 항체가 풍부한 혈장의 개발을 용이하게 하기 위해 노력하고 있다.
FDA는 빠른 승인 과정을 통해 효과적인 제품을 가져오기 위해 새로운 방법을 찾고 있고 현재 접근이 부족한 시골 병원 등 기관에 임상시험에 접근을 확대하고 있다.유럽의약청(EMA)은 코로나19에 대해 잠재력이 있는 약 40개 치료제 개발자와 협력하고 있다.
현재 가장 유망한 후보들은 개발 중인 항바이러스제 렘데시비르(remdesivir), HIV 약품 로피나비르/리토나비르(lopinavir/ritonavir), 항말라리아제 클로로퀸(chloroquine)과 하이드록시클로로퀸(hydroxychloroquine), 전신 인터페론(다발경화증), 단클론항체 등이다.
고재구 기자
news@pharmstoday.com

