신속심사 및 우선심사 적극 활용
지난해 미국 FDA는 의학적 미충족 요구를 충족시키거나 환자의 치료를 진전시키는데 도움이 되는 혁신적인 의약품의 승인 건이 많았다.
실제 승인된 신약의 21%는 바이오신약, 44%는 희귀의약품, 42%는 혁신신약(first-in-class) 등으로 나눠지며 새로운 영역으로 확장됐다.
또한 신속한 개발 및 승인을 촉진하기 위한 신속심사와 우선심사 등의 규제경로를 적극 활용하는 모습을 보였다.
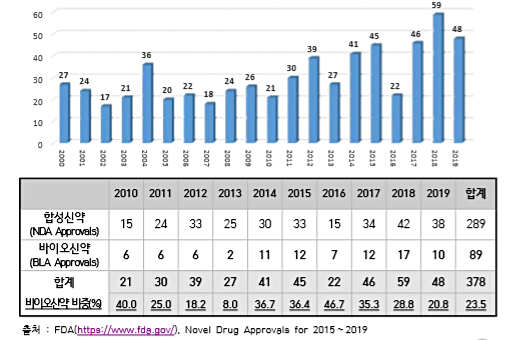
2019년 한 해 동안 미국 FDA 의약품평가센터(CDER)가 허가한 신약은 총 48건으로 집계됐다. 이 중 합성신약은 38건, 바이오신약은 10건으로 나타났다.
지난해 승인된 바이오신약은 ▲유방암 치료제 인허투(Enhertu) ▲방광암 치료제 패드세브(Padcev) ▲낫형세포병(sickle cell disease) 치료제 아닥베오(Adakveo) ▲빈혈 치료제 레블로질(Reblozyl) ▲습성황반변성 약품 비오뷰(Beovu) ▲림프암치료제 폴리비(Polivy) ▲건선치료제 스카이리지(Skyrizi) ▲골다공증 치료제 이베니티(Evenity) ▲후천성 혈전성 혈소판 감소성 자반증 치료제 카블리비Cablivi) ▲보툴리눔 톡신 주보(Jeuveau) 등이 승인됐다.
희귀질환(Rare Diseases); 신속심사, 우선심사
48건의 신규허가 중 21건이 희귀의약품 지정을 받은 신약으로 낭포성 섬유증, 겸상적혈구질환, 시신경척수염(neuromyelitis optica spectrum disorder), 전신경화증 관련 간질성폐질환(systemic sclerosis-associated interstitial lung disease(SSc-ILD) 등의 치료제가 승인됐다.
특히 희귀질환 치료제들은 신속한 개발 및 승인을 촉진하기 위한 제도인 신속심사, 우선심사 등의 규제경로를 적극 활용했다.
48건 중 17건은 신속심사(Fast Track), 13건은 획기적 치료제(Breakthrough therapies)로 지정됐다.
28건은 우선심사(Priority Review) 대상으로 지정됐으며, 9건은 가속승인(Accelerated Approval) 대상으로 지정되기도 했다.
더불어 48건 중 33건(69%)은 다른 국가에서 승인받기 전에 미국에서 최초로 승인됐으며, 43건(90%)은 최초허가신청서(first cycle)로 승인이 처리됐다.
심장, 폐, 순환기 및 내분비 질환(Heart, Lung, Circulatory, and Endocrine Diseases)에는 트랜스티레틴 매개성 아밀로이증(transthyretin mediated amyloidosis), 정맥혈전색전증, 당뇨병 등을 치료하는 치료제가 나왔다.
자가면역(Autoimmune Conditions)은 전신성 홍반성루프스(systemic lupus erythematosus), 비방사선학적 척추관절염(non-radiographic axial spondyloarthritis), 람베르트- 이튼 근무력 증후군(Lambert-Eaton myasthenic syndrome) 등의 치료제가 새로 승인됐다.
여성·남성 특정 건강문제(Women’s and Men’s Specific Health Issues) 영역에는 여성의 성욕 감소장애, 산후우울증, 남성의 성선기능저하증 등의 치료제 승인됐다.

