라니티딘·니자티딘 각각 A·B로 기재
라니티딘에 이어 니자티딘 제품 일부에서 NDMA가 검출됨에 따라 관련의약품의 재처방 등과 관련해 청구방법이 개정된다.
건강보험심사평가원은 4일 니자티딘 성분 의약품의 재처방 및 재조제 관련 청구방법 개정에 대해 공고했다. 이는 11월 22일 조제분부터 적용된다.
심평원은 니자티딘 성분 위장약의 제조·수입 및 판매 중지에 따른 해당 성분 보험의약품 재처방·재조제 명세서 특정내역 구분코드 설명란을 개정했다고 설명했다.
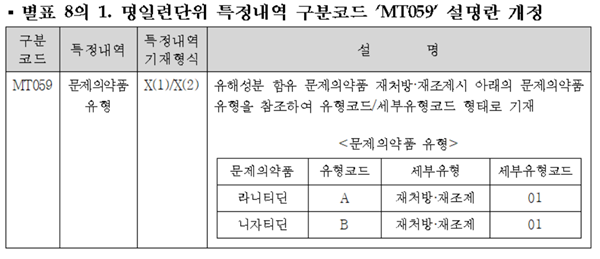
요양기관에서 청구 신청을 할 때 특정내역 구분코드 중 MT059로 기재하고 설명란은 개정에 따라 유해성분 함유 문제의약품 재처방·재조제시 라니티딘과 니자티딘을 각각 A, B 코드로 구분해 기재해야 한다.
이는 지난 11월 22일 식품의약품안전처와 보건복지부 발표에 대한 후속조치이다.
당시 식약처는 니자티딘 성분 의약품 수거검사 결과 ‘N-니트로소디메틸아민(NDMA)’ 검출됨에 따라 완제의약품 13품목에 대해 잠정적으로 제조 및 판매를 중지하고 처방을 제한하도록 조치했다.
식약처는 원료의약품 불순물 안전관리 대책을 발표하고 해당 의약품이 병‧의원과 약국에서 처방‧조제되지 않도록 하고 급여 적용도 정지했다.
복지부도 같은 날 니자티딘 성분 보험의약품과 관련한 FAQ를 안내했으며 지난 3일 요양급여비용 청구방법과 심사청구서·명세서서식 및 작성요령 일부개정안을 발표했다.
이소영 기자
news@pharmstoday.com

