자료공유, 용법‧용량 구분기재 등 근거 마련
식약처가 한약제제 특성에 맞는 허가·신고 체계 개선을 추진한다.
식품의약품안전처(처장 이의경)는 의약품 위·수탁 품목 허가·신고 시 위·수탁 간 자료공유 근거 마련 등을 주요 내용으로 하는 ‘한약(생약)제제 등의 품목허가․신고에 관한 규정’ 일부개정고시(안)을 29일 행정예고 했다.
이번 행정예고는 ‘의약품의 품목허가·신고·심사 규정’의 개정사항을 반영해 행정절차를 통일하고, 불필요한 절차를 개선해 의약품 허가(신고)의 효율성을 높이기 위해 추진됐다.
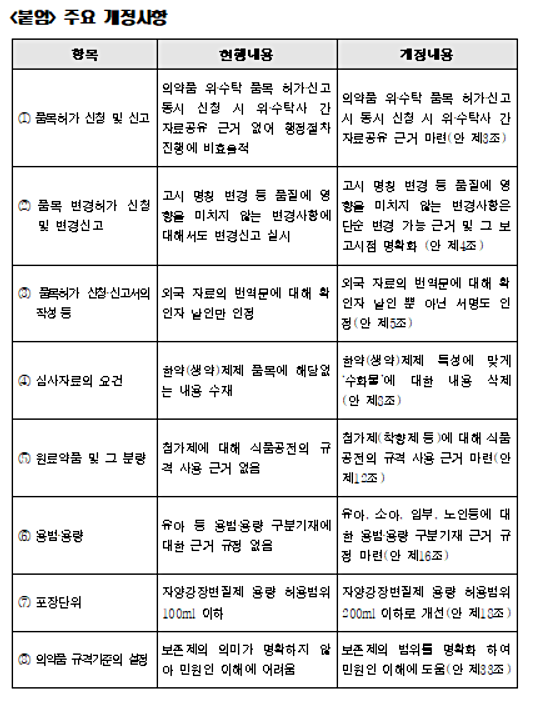
주요 개정사항을 살펴보면 ▲의약품 위·수탁 품목 허가·신고 시 위·수탁 간 자료공유 근거 마련 ▲한약(생약)제제 품목의 특성에 맞는 심사 자료 개선 ▲식품공전 규격의 첨가제 사용 등이 포함된다.
품목허가의 신청 및 신고를 위해서는 현행 자료공유에 대한 근거 없어 행정절차가 비효율적이었던 사항을 의약품 위‧수탁 품목 허가‧신고 시 동시 신청 시 위·수탁사 간 자료공유의 근거를 마련했다.
품목의 변경허가 신청에 대해서는 고시 명칭 변경 등 품질에 영향을 미치지 않는 변경사항은 단순 변경 가능 근거 및 그 보고시점 명확화했다.
또한 유아 등 용법‧용량 구분기재에 대한 근거 규정이 없었던 항목을 유아, 소아, 임부, 노인등에 대한 용법‧용량 구분기재 근거 규정을 마련했다.
포장단위는 자양강장변질제 용량 허용범위 100ml 이하에서 200ml 이하로 개선했다.
식약처는 “이번 개정 추진을 통해 한약(생약)제제 특성에 맞는 품목허가(신고) 체계를 갖추어 나갈 것으로 기대한다”며 “앞으로도 안전과 품질이 확보된 한약(생약)제제를 국민들에게 공급할 수 있도록 제도 개선 등 지속적으로 노력할 것”이라고 밝혔다..
한편 개정안에 대한 의견은 12월 19일까지 식약처(한약정책과)에 제출할 수 있다.