경구 HIF-PHI 출현…GSK·아스텔라·미쓰비시 등 日 승인 임박
암젠의 에포젠/프로크릿(Epogen/Procrit), 아라네습(Aranesp) 등 주사제가 지배하는 ESA(erythropoiesis-stimulating agents) 시장에 새로운 경쟁이 시작되고 있다.
GSK는 일본에서 만성신질환(CKD)과 관련된 빈혈 치료에 새로운 경구 약품인 다프로두스타트(daprodustat)의 마케팅 승인을 신청했다고 최근 밝혔다.승인될 경우, 다프로두스타트는 주사제인 에포젠, 아라네습과 교와 기린의 에스포(Espo/epoetin alfa), 네습(Nesp)과 바이오시밀러 등 ESA의 경구 대안이 될 것이다.
CKD 환자의 빈혈은 적혈구 생성을 촉진하는 호르몬인 적혈구생성인자(erythropoietin)의 결핍이 원인이다.다라프로두스타트(HIF-PHI : hypoxia-inducible factor prolyl hydroxylase inhibitor)는 일본 후생노동성에서 승인되면 교와 기린이 일본에서 마케팅할 예정이다.
GSK의 일본 승인 신청은 일본에서 다프로두스타트의 임상 3상 연구 데이터를 근거로 했다.연구는 혈액 투석 환자에서 암젠의 아라네습과 다프로두스타트의 비교 임상, 혈액투석을 받지 않는 CKD 환자에게 시험 치료제 에포틴 베타 페골(epoetin beta pegol) 등 2개이다.
두 임상에서 경구 다프로두스타느는 주사제만큼 헤모글로빈의 수준 증가에 우수함을 보였다.GSK는 새로운, 경구 치료제와 경쟁에 직면하고 있다.
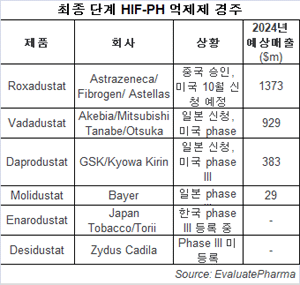
또한 일본 등 일부 아시아 시장에 미쓰비시 다나베 파마에 라이선스한 아케비아(Akebia)의 최종 임상 중인 바다두스타트(vadadustat)가 추가 경쟁자로 다가오고 있다.
반면 아스텔라스 파마는 록사두스타의 일본과 유럽에서 권리를 갖고 있고 이런 지역에서 임상 3상을 진행하고 있다.아스텔라스 파마는 록사두스타트를 작년 10월 일본에서 승인을 신청해 올해 말 최종 결정을 기다리고 있다.
미쓰비시는 지난달 일본에서 승인을 신청해 아스텔라스보다 약간 뒤처져 있다.일본에서 경구 HIF-PHI의 잇따른 승인 가능성이 시장 쟁탈전의 전조가 되고 있다.
GSK는 다른 지역에 접근하기 위해 투석이 필요한 환자와 투석이 필요없는 환자 등 2개의 글로벌 임상 3상 시험을 진행하고 있으며, 그 중 하나는 등록을 마쳤다.아케비아는 2020년 글로벌 연구 결과를 발표할 예정이며, 피브로젠은 파트너인 아스트라제네카와 협력으로 10월에 미국 FDA 승인을 신청할 계획이다.
미국 FDA에 따르면 ESA는 적혈구 생성을 자극하지만 혈전과 다른 심혈관 부작용의 원인이 될 수 있다.반면, HIF-PHI 약품은 에리트로포이에틴의 내성 생성을 자극하고 혈액 내 EPO 수치를 낮추지만, 이런 메커니즘이 더 일정한 수준으로 이끌어 합병증을 피할 수 있다고 연구자들은 생각하고 있다.
경구 치료제는 다른 장점들이 있다.쉬운 관리가 한가지이지만, ESA와 달리 HIF-PHI는 냉장 보관으로 유지할 필요가 없다.

