로슈, 100억$ 빅3 항암제 지배…제네릭 경쟁 거셀 듯
글로벌 제약사의 일부 최대 매출 약품들이 올해 특허만료에 직면하고 있다.
제약사들은 큰 수익을 올리는 효자상품을 보호하기 위해 가능한 한 오랫동안 특허권 만료와 제네릭 경쟁을 물리치기 위해 최선을 다하지만, 올해 업계의 많은 톱 브랜드들이 한계에 직면해 있는 것이다.
리서치업체인 피어스파마가 주요 미국 특허는 만료되지만 다른 특허가 유효한 약품을 제외한 올해 미국 특허만료 제품 톱 10을 선정한 보고서를 발표했다.
보고서에 따르면 화이자의 리리카(Lyrica), GSK의 애드브에어(Advair), 로슈의 리툭산(Rituxan), 길리어드 사이언스의 하보니(Harvoni)와 많은 다른 약품들이 올해 새로운 제네릭이나 바이오시밀러 경쟁에 직면할 예정이거나 직면하고 있다.
로슈는 최대 특허 상실이 예상된다.회사는 리툭산을 비롯해 허셉틴(Herceptin), 아바스틴(Avastin) 등 3개 메가블록버스터 항암제가 올해 미국 경쟁이 예상되고 있다.
3개 항암제의 작년 미국 매출은 총 100억 달러 이상으로 바이오시밀러 회사의 큰 타깃이다.혈액암과 류마티스 관절염 치료제인 리툭산은 올해 미국 특허만료되는 톱 약품이다.
이 제품은 올 하반기에 바이오시밀러 경쟁이 예상된다.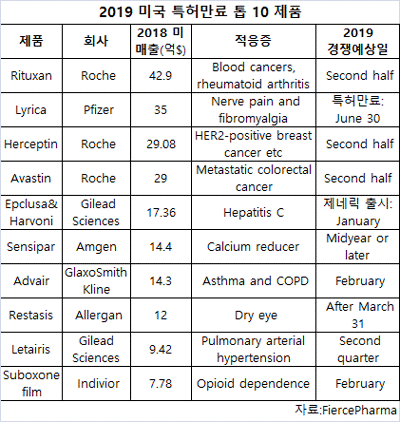
리툭산은 작년 미국에서 전년대비 4% 신장된 42.9억 달러 매출을 기록했다. 하지만 유럽에서는 바이오시밀러 경쟁은 매출이 47% 급락했다.
미국에서 셀트리온과 테바가 리툭산 바이로시밀러인 트룩시마(Truxima)를 작년 11월 FDA에서 승인받았다.
그러나 정확한 출시 시기는 알려지지 않았다.
암젠, 화이자, 산도스 등도 리툭산을 표적으로 각각의 바이오시밀러를 개발하고 있다.1998년 승인된 유방암 치료제 허셉틴은 작년 미국 매출은 29억 달러를 기록했다.
3개 허셉틴 바이오시밀러 버전이 이미 FDA 승인을 받았고 로슈에게 일부 심각한 압박이 될 수 있다.이 제품은 6월 18일 주요 미국 특허를 상실하고 회사는 하반기에 바이오시밀러 진입을 예상했다.
셀트리온, 삼성 바이오에피스, 마이란이 미국에서 바이오시밀러 승인을 받았고 첫 출시 이후 허셉틴은 미국에서 총 365억 달러 매출을 기록했다.로슈는 허셉티의 미국 바이오시밀러 경쟁을 준비하고 있고 HER2+ 유방암 치료제인 후속 약품인 카드사이라(Kadcyla)의 도약을 기대하고 있다.
허셉틴과 DM1 화학요법제를 복합한 카드사이라는 2013년 FDA 승인을 받았지만 작년 매출 9.8억 달러로 아직 로슈의 기대에 미치지 못했다.새로운 미국 경쟁은 허셉틴의 유럽 바이오시밀러 진입을 따를 것이고, 로슈 항암제는 이미 바이오시밀러에게 시장을 내주고 있다.
2018년 유럽에서는 허셉틴 매출은 16% 감소했다고 로슈가 보고했다.아바스틴은 미국에서 올해 바이오시밀러 경쟁에 직면하는 로슈의 세 번째 블록버스터 항암제이다.
2004년 승인된 아바스틴은 대장암, 폐암, 신세포암 등 일부 유형의 암 치료에 사용된다. 이 제품은 작년 미국에서 29억 달러 매출을 올렸다.출시 이후 아바스틴은 미국에서만 총 480억 달러 이상을 로슈에게 안겨 주었다.
암젠은 아바스틴 바이오시밀러 버전인 엠바시(Mvasi)를 이미 승인받았고 삼성바이오에피스, 셀트리온 등이 바이오시밀러의 승인을 찾고 있다.유럽에서 화이자는 작년 12월 아바스틴의 바이오시밀러의 승인 권고를 받았다.
아바스틴, 리툭산도 올 하반기에 바이오시밀러 경쟁에 직면할 것으로 예상된다.2004년 첫 승인된 화이자의 리리카는 큰 성과를 거뒀지만, 이제 끝이 다가오고 있다.
작년 미국에서 35억 달러를 매출을 올린 후 약품은 6월 30일 주요 특허만료로 제네릭의 맹공이 예상된다.FDA에서 첫 승인 후 리리카는 미국에서 총 300억 달러 이상 매출을 기록했다.
리리카의 특허절벽은 향 후 수년간 회사의 마지막 주요 만료이다.신경병성 통증과 섬유근육통 치료에 사용되는 리리카는 2018년 말에 오리지널 특허를 상실했다.
하지만 화이자는 소아 환자에 대한 FDA에서 6개월 독점권을 추가했다.현재 테바, 마이란, 산도스와 많은 다른 제네릭 업체들이 출시를 기다리고 있다.
길리어드는 모든 유전자형 치료제인 엡클루사(Epclusa)와 한때 가장 급등했던 하보니(Harvoni) 등 만성 C형 간염(HCV) 치료제로 힘든 상황에 처해 있다.이에 대해 회사는 이전에 제약사에서 전례가 없는 일을 했다.
길리어드는 FDA 승인 후 불과 몇 년 만에 자체 브랜드 약품의 제네릭을 출시하기로 결정했다.길리어드의 HCV 약품의 안전성은 2014년, 2015년, 2016년 출시 후 힘찬 출발을 했지만 최근에는 다른 제약회사와의 경쟁 및 보험사와의 힘든 협상으로 판매가 위축됐다.
엡클루사는 2016년 FDA에서 승인됐고 미국에서 약 90억 달러 매출을 올렸다.2015년 출시한 하보니는 2016년 미국 매출은 49억 달러를 기록했다.
작년 엡클루사의 미국 매출은 9.34억 달러, 하보니는 8억 달러로 크게 떨어졌다.길리어드는 엡클루사와 하보니의 공인된 제네릭을 출시하기 위해 자회사 아세과 테라퓨틱스(Asegua Therapeutics)를 출범했다.
공인된 제네릭은 코스당 2만 4000달러로 엡클루사 7만 6740달러, 하보니 9만 4500달러에 비해 크게 낮췄다.길리어드는 올해 르태리스(Letairis), 라넥사(Ranexa)도 올해 제네릭 경쟁에 직면하게 된다.
2007년 폐동맥고혈압 치료제인 길리어드의 르태리스는 올해 특허만료가 다가오고 있다.길리어드는 작년 한가지 특허만료 후 경쟁을 준비하고 있었지만 제네릭 메이커들이 FDA 문턱을 넘지 못했다.
르태리스는 작년 미국 매출 9.4억 달러 길리어드의 중요한 매출 자원이다.HCV 약품의 작년 매출에 르태리스와 라넥사의 7.6억 달러를 추가해 길리어드의 미국 총매출 34억 달러가 제네릭 표적이 되고 있다.
특허만료 후 약 1년간 암젠의 칼슘 감소제 센시파(Sensipar)는 제네릭 경쟁에서 벗어나 있다.제네릭의 부족으로 센시파는 작년 미국에서 14.3억 달러 매출을 기록했다.
하지만 센시파는 곧 제네릭 경쟁에 직면할 수 있다.제네릭 제약사들이 FDA 승인을 받았고 일부 업체들이 특허 소송이 진행 중임에도 불구하고 제네릭을 위험부담을 안고 출시하기로 결정할 수도 있기 때문이다.
테바는 작년 말 그렇게 했다.이런 출시는 센사파의 제네릭 예상 업체와 암젠의 이전 딜에 가속 조항 때문에 다른 업체를 촉발시켰을 수도 있다.
이로 인해 암젠은 테바와 신속한 합의를 선택했다.일부 제네릭 메이커들은 아직 합의하지 않았다.
센시파의 문제 특허 성분은 3월에 만료되지만 암젠은 많은 제네릭 업체와 특허분쟁에 있다.센시파 이외에도 암젠은 뉴라스타(Neulasta)와 에포젠(Epogen)은 물론 빅셀링 약품인 엔브렐(Enbrel)의 바이오시밀러 경쟁에 직면하고 있다.
암젠은 엔브렐의 특허 소송이 해결되려면 시간이 걸릴 것이기 때문에 바이오시밀러들이 언제 시장에 나올지는 분명치 않다고 밝혔다.노바티스는 이미 에렐지(Erelzi)란 엔브렐의 바이오시밀러를 FDA 승인을 받았다.
GSK의 블록버스터 호흡기 치료제인 애드브에어/세레타이드는 제네릭 경쟁에 직면하고 있다.마이란이 지난 1월 제네릭 버전을 FDA에서 승인받아 2월 출시해 수년간 독점에 종지부를 찍었다.
GSK는 애드브에어의 특허를 2010년에 상실했지만 디스커스 흡입기 기술은 복제가 어렵고 기기 자체는 2016년까지 특허를 잃지 않았다.하지만 마지막 특허만료 후 제네릭 메이커들은 FDA 검토를 거쳐 제네릭의 승인을 얻기 위해 고군분투했다.
마이란은 1월 승인 전에 많은 거부와 연기로 어려움을 겪었다.애드브에어의 매출은 2013년 52.7억 파운드로 정점을 찍은 후 2018년 미국 24억 파운드를 기록했다. 작년 미국 매출은 14.2억 달러를 올렸다.
노바티스, 하이크마, 벡튜라 등이 애드브에어의 제네릭을 개발하고 있지만 2020년 이후에 출시될 것으로 예상된다.작년 미국에서 12억 달러 매출을 기록한 엘러간의 안구건조증 치료제 레스타시스(Restasis)도 제네릭 경쟁을 앞두고 있다.
제네릭이 작년 출시될 것으로 예상된 후에도 엘러간은 여전히 독점권을 가지고 있다.테바, 마이란, 암니얼과 다른 다수 제네릭 제약사들이 레스타시스의 일부 시장을 원하고 있다.
마약성 진통제 중독 치료제인 수복숀(Suboxone) 필름은 앞선 태블릿 버전이 제네릭 경쟁에 떨어진 이후 영국 제약사 인디비올(Indivior) 사업의 초석이 되었다.현재 치열한 법정 분쟁 후 수복숀 필름은 제네릭 공격에 직면하고 있다.
인도 제약사인 닥터 레이디스는 여전히 특허소송 중에 있지만 위험을 무릅쓰고 제네릭을 출시했다.인디비올은 인도 제약사의 출시 중단을 판결했지만 미국 항소법원은 이런 판결을 기각하고 회사의 재고 요구를 거부했다.
특허 분쟁에도 일부 제네릭 메이커들은 출시를 강행했고 인디비올은 자신의 공인된 제네릭을 내놓고 치열한 경쟁을 예고하고 있다.인디비올은 대부분 수복숀(7.78억$)에서 나온 작년 미국 매출은 총 7.9억 달러를 기록했다고 보고했다.

