트레베나, 록소, 아스텔라 등 표적 항암제 승인 심사
FDA는 부활절 후 2개 항암제의 승인 결정 등으로 분주한 주말을 보내고 있다.
진통제는 에이스엘엑스 파마슈티컬(Acelrx Pharmaceuticals)과 트레베나(Trevena)의 2개가 최종 결정을 기다리고 있다.에이스엘엑스의 디수비아(Dsuvia)는 미국 FDA 자문위원회에서 10-3으로 승인을 지지받은 반년 트레베나의 올린보(Olinvo, oliceridine)는 8-7로 거부됐다.
3개의 새로운 표적 키나제 억제제가 첫 승인을 대기하고 있다.비소세포폐암에 화이자의 로라티닙(lorlatinib)에 대한 부족한 데이터는 8월부터 지연됐다.
연구는 젤코리(Xalkori) 등 Alk 억제제 치료에 후 진행된 Alk 변이 환자의 치료에 기획됐다.반면 바이엘의 라로트렉티닙(Larotrectinib)은 질병이 NTRK 유전자 융합에 의해 드라이브된 환자에게 종양 애그노스틱(tumour-agnostic) 약품으로 신청됐다.
아스텔라스 파마의 질테리티닙(gilteritinib)은 FLT3 변이가 있는 재발/난치성 급성 골수성 백혈병 치료에 승인을 기다리고 있다.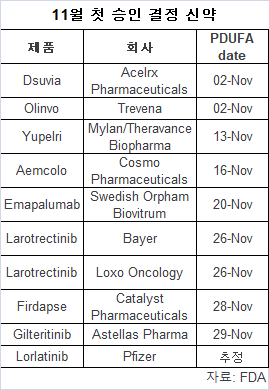
노빔뮨(Novimmune)이 개발한 항인터페론 감마 항체인 에마파루맙은 SOB가 최근 인수했다.
카타리스트 파마(Catalyst Pharmaceuticals)의 피답세(Firdapse)는 희귀병 람베르트-이튼 근무력 증후군( Lambert-Eaton myasthenic syndrome)에 미국에서 첫 승인될 수 있다.이밖에도 2개의 바이오시밀러가 승인을 기다리고 있다.
코헤루스 바이오사이언스의 유데니카(Udenyca)는 올해 초 완전검토서한(CRL)을 받았고 두 번째 검토가 진행 중에 있다.승인된다면 암젠의 뉴라스타(Neulasta)의 바이오시밀러인 마이란의 풀필리아(Fulphilia)를 뒤따르게 된다.
마이란은 사노피의 란투스(Lantus) 바이오시밀러인 바사로그(Basalog)의 승인을 기대하고 있다.
고재구 기자
news@pharmstoday.com

