총 4842건·올해 398건으로 지난해와 비슷…소화기질환 급증
치료목적의 임상시험용의약품 사용승인 건수가 약 5000여건에 달하는 가운데 폐암 등 호흡기질환이 가장 많은 것으로 나타났다.
29일 식품의약품안전처에 따르면 생명이 위급한 응급환자들이나 대체 치료수단이 없는 환자 등의 치료기회 확대를 위한 ‘임상시험용의약품의 치료목적 사용승인’ 건수가 올해 7월까지 총 4842건으로 확인됐다.임상시험용의약품의 치료목적 사용승인 제도는 2002년부터 시행됐다.
사용승인 건수는 2016년 793건, 2017년 703건이었으며, 올해는 7월까지 398건으로 지난해와 비슷한 추세로 승인됐다.올해 사용승인 건수 398건을 질환별로 보면 폐암 등 호흡기질환 202건으로 가장 많았고, 그 뒤로 위암 등 소화기질환 110건, 유방암 등 여성질환 39건, 악성흑색종 등 피부질환 21건, 백혈병 등 혈액질환 10건, 기타 질환 16건 등의 순이었다.
지난 2016년과 2017년 승인 건수를 살펴보면 폐암 등 호흡기질환이 631건에서 389건으로 감소한 반면, 위암 등 소화기질환은 75건에서 203건으로 크게 늘어 주목된다. 올해는 지난해와 비슷한 추세로 예측되고 있다.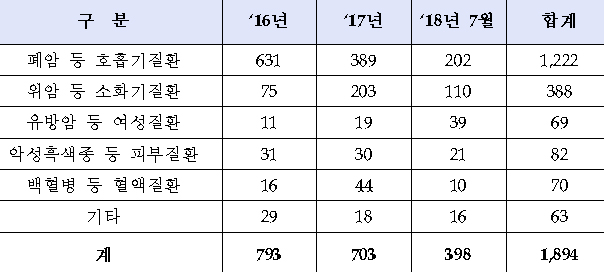
치료목적 사용승인 제도는 원칙적으로 임상시험용으로만 사용할 수 있는 의약품을 품목허가를 받기 전에 예외적으로 사용할 수 있도록 승인하는 제도이다.
미국과 유럽 등에서도 우리나라와 동일하게 해당 국가에서 임상시험 승인을 받은 의약품에 한해 치료목적으로 사용할 수 있도록 하고 있다.식약처는 지난해 8월부터 중증질환자 등에 대한 치료기회 확대를 위해 환자나 보호자가 승인받은 임상시험용의약품 코드명, 대상 질환, 사용되는 병원 등을 손쉽게 확인할 수 있도록 치료목적 사용승인 현황을 홈페이지를 통해 공개하고 있다.
참고로, 국내에서 개발 중인 방사성의약품(루테슘, Lu177)은 보건복지부 예산을 지원받아 동물실험 등 연구 진행 중에 있으며, 임상시험 승인을 받지 않아 최소한의 안전성이 검증되지 않은 물질로 ‘치료목적 사용승인’ 대상이 될 수 없다.식약처는 앞으로도 환자들이 필요한 의약품을 제 때에 사용될 수 있도록 제도적 지원을 추진해 나가기로 했다.
조정희 기자
news@pharmstoday.com

