관련 규정 위반 사례 2건 적발… 행정·시정 조치
의료기관 내 설치된 임상시험심사위원회(IRB)에 대한 실태조사에서 2건의 관련 규정 위반 사례가 적발돼 행정조치됐다.
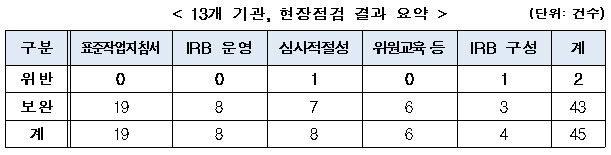
식품의약품안전처는 8일 의료기관 내 설치된 임상시험심사위원회(IRB) 구성·운영의 적절성 등을 확인하기 위한 실태조사 결과, 임상시험대상자 안전 및 임상시험 결과의 신뢰성에 영향을 주는 중대한 위반사항은 없었다고 밝혔다.
다만, IRB 위원 위촉 이전에 심사업무를 진행(1건)했거나 IRB 심사 시 임상시험자자료집 검토를 누락(1건)하는 등 관련 규정을 위반한 사례가 확인됐다.
식약처는 이들 위반 사례에 대해 행정처분 및 시정조치 했다.
임상시험심사위원회(IRB)란 임상시험에 참여하는 대상자의 권리·안전·복지를 위해 의료기관(시험기관) 내 독립적으로 설치한 상설위원회를 말한다.
이번 점검은 의료기관에서 실시되는 임상시험의 안전성과 윤리성을 심의하는 IRB의 독립성과 공정성을 검증하기 위해 실시됐다.점검 대상은 국내 임상시험 승인 건수의 75% 이상을 차지하는 상위 30개 의료기관 가운데 2017~2018년 점검실적이 없는 13개 기관으로 선정했다.
식약처는 “향후 임상시험에 참여하는 대상자의 권리·안전·복지가 보장될 수 있도록 IRB 독립성·공정성 확보를 위한 운영표준안을 마련하는 등 임상시험 안전관리에 만전을 기하겠다”고 밝혔다.
조정희 기자
news@pharmstoday.com

