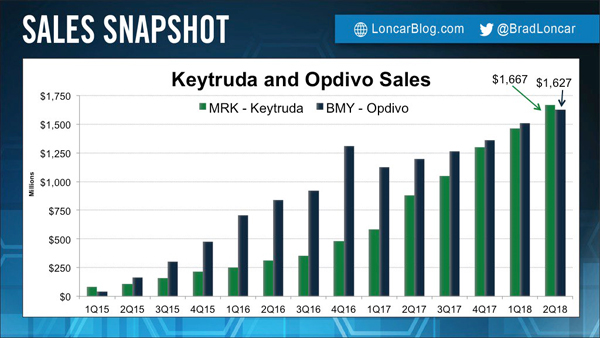
2Q 16.7억$ : 16.3억$…폐암 1차 라인 승패 갈라
면역항암제 PD-1/L1 경쟁에서 MSD가 BMS를 처음으로 추월했다.
면역항암제 분야에서 2개의 강력한 제품은 MSD의 키트루다(Keytruda)와 BMS의 옵디보(Opdivo).체크포인트 억제제인 PD-1/L1 억제제는 종양을 더 활발하게 공격하기 위해 면역시스템을 자극하는 성분이나 기술을 결합한다.
지금까지 BMS의 옵디보가 PD-1/L1 계열에서 최고 매출 약품이었으나 올해 2분기 실적 보고에서 처음으로 MSD의 키트루다가 BMS의 옵디보를 앞선 것으로 나타났다.2분기 키트루다의 매출은 16.7억달러로 전년동기대비 89% 급증했다.
키트루다는 2014년 마케팅된 이후 매분기 성장을 지속해 왔다.
BMS는 옵디보의 매출은 1년 전에 비해 36% 증가한 16.3억달러를 보고했다.반면 PD-L1 억제제인 로슈의 티쎈트릭(Tecentriq)은 2분기 37% 증가한 3.2억 스위스 프랑(3.21억$)의 매출을 기록해 두 제품과 큰 격차를 보이고 있다.
2016년 미국 FDA는 최소 50%의 PD-L1 발현이 있는 전이성 비소세포폐암 환자의 1차 라인 치료에 키트루다를 승인했다.
승인은 옵디보가 최소 5% PD-L1 발현이 있는 전이성 비소세포폐암 환자의 주요 임상 3상에서 실패 한 후 두 달 만에 나왔다.더 앞선 세팅에 승인은 비소세포폐암 시장에서 더 높은 점유를 키트루다에게 허용했다.
이후 FDA는 PD-L1 발현과 상관없이 전이성 비평편상피 비소세포폐암의 1차 라인 치료에 화학요법과 복합으로 키트루다의 추가 사용을 허가했다.반면 옵디보는 1차라인 폐암에 아직 승인을 받지 못했다.
BMS는 종양변이부담이란 바이오마커의 특정 수준이 있는 진행성 비소세포폐암 환자의 1차 라인 치료로 옵디보와 여보이(Yervoy)의 복합요법을 승인 신청을 했다.FDA는 내년 2월 20일에 최종결정을 계획하고 있다.
로슈의 티쎈트릭은 백금 화학요법제 동안 혹은 이후 질병이 진행된 비소세포폐암 환자와 FDA 승인 약품으로 치료에 이어 질병이 진행되는 종양에서 EGFR 혹은 ALK의 이상이 있는 환자의 치료에 허가를 받았다.
6월 평편상피 종류의 질병이 있는 환자의 단독 화학요법과 비교해 36%까지 질병 위험을 감소한 전이성 비평편상피 비소세포폐암의 1차 라인으로 유일하게 승인된 키트루다와 화학요법제의 복합요법에 대한 데이터를 발표했다.이런 연구들은 키트루다의 입지 보장에 도움이 되고 있다.
반면 BMS는 2차 라인 분야에서 낙관적이고 특히 복합요법과 관련해 옵디보의 라벨 확대 기회를 찾고 있다.회사는 미국 이외에서 2차 라인 폐암 시장에서 상대적으로 안정적으로 유지할 수 있다고 밝혔다.
리서치업체인 EP(EvaluatePharma)의 보고서를 보면 2024년 항암제 중 키트루다는 매출 126.8억달러(연평균 +19%)로 1위에 랭크될 전망이다.반면 옵디보는 같은 해 매출 112.4억달러(연간 +10%)로 3위로 예상된다.
고재구 기자
news@pharmstoday.com

