승인 수도 최다…신속검토 경로 효과 톡톡
미국 FDA가 신약 승인 기간이 다른 국가의 당국보다 더 빠른 것으로 나타났다.
CIRS(Centre for Innovation in Regulatory Science)의 보고서에 따르면 FDA는 2017년 새로운 활성 성분(new active substance)의 제품 승인에 평균 243일이 걸렸다.이는 일본 PMDA(Pharmaceuticals and Medical Devices Agency)의 333일보다 90일이 짧았다.
FDA는 지난 10년간 다른 당국보다 신약 승인의 기간이 일반적으로 더 짧았지만 약품 평가를 가속화하기 위한 일본의 노력은 2014~16년까지 가장 빠른 검토에서 PMDA가 FDA를 앞섰다.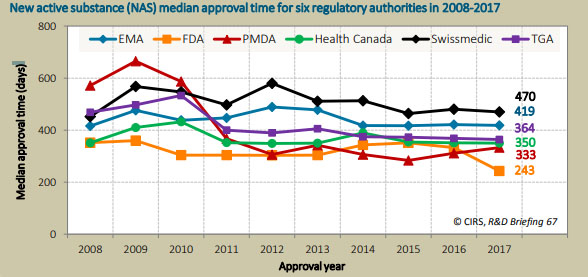
FDA와 PMDA에 이어 헬스 캐나다(Health Canada) 신약의 가장 빠른 승인 국가로 3위에 올랐고 TGA(Australian Therapeutic Goods Administration) EMA(European Medicines Agency) 스위스메딕(Swissmedic)은 각각 2015~16년 비슷한 심사 기간을 보였다.
FDA는 50개로 다른 당국보다 신약 승인 수도 가장 많았다.
신약 승인 수는 EMA와 헬스 캐나다 각각 30개, 스위스메딕 29개, TGA 24개, PDMA 22개 등이다.
신속 검토 경로의 사용 증가가 빠르게 심사하는 FDA 능력에 의미있게 기여했다고 보고서가 평가했다.
2017년 FDA에서 승인된 신약의 62%는 우선검토와 40%는 혁신약품 지정을 받았다.
FDA는 전체적으로 다른 당국보다 더 빨랐지만 EMA와 헬스 캐나다는 신속 검토에서 FDA보다 더 빨랐다.
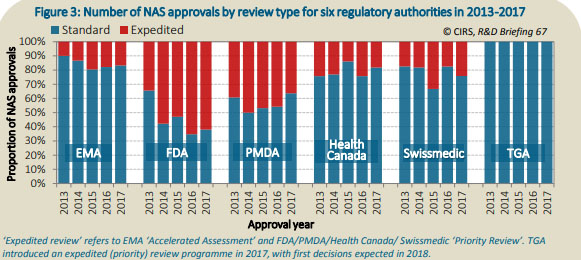
EMA는 신속 평가로 제품 승인까지 평균 235일, 헬스 캐나다는 우선 검토로 승인까지 209일이 걸렸다.더 많은 신약이 2008~2012년까지 12개에서 2013~2017년 51개로 6곳 당국에서 과거에 비해 더 많이 승인됐다.
FDA와 EMA에 신청은 대부분 제품에서 거의 같은 시기에 있은 반면 두 곳과 4곳의 다른 당국 사이의 차이는 80~100일로 나타났다.
고재구 기자
news@pharmstoday.com

