식약처, 49품목 사용상의 주의사항 변경…의견조회 실시
지질영양주사제 '스모프리피드20%' 등 49개 품목에 대해 미숙아 사망사례가 추가된다.
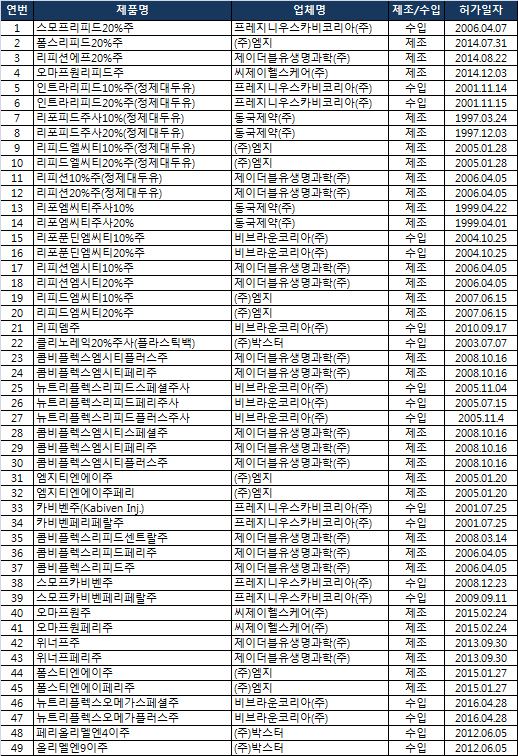
식품의약품안전처장(처장 류영진)은 ‘스모프리피드20%주’ 등 49개 품목의 허가사항에 약물 투여 후 미숙아 사망 사례가 문헌으로 보고됐다는 경고 내용 등을 반영해 변경허가한다고 11일 밝혔다.
이번 변경허가는 미국 FDA에서 해당 약물에 대한 경고 문구와 스모프리피드20%주 변경허가 신청 사항 등을 검토한 결과, 정제대두유 함유 주사제에 공통적인 주의사항에 반영이 필요하다고 판단한데 따른 것이다.
변경되는 허가사항은 ‘미숙아 및 저체중 영아는 정맥 내 지질 제거율이 낮아 지질액 주사 시 혈장 중 유리지방산 수치가 증가할 수 있다는 보고가 있다’와 ‘정제대두유 단일주사제를 심각한 호흡기질환을 가진 미숙아에게 정맥 투여한 후 사망한 사례가 문헌으로 보고되어 있고, 부검결과 폐혈관 내 지방축적이 확인되었다’ 등이다.올해 1월 이대목동병원 신생아 사망사고는 시트로박터프룬디균에 오염된 주사제를 사용해 발생한 것으로 해당 약물의 부작용과는 무관하다고 식약처는 설명했다.
당시 부검을 했을 때 모든 아이들의 폐혈관에서 지방축적(지방색전증)은 관찰되지 않았다는 것이다.식약처는 오는 4월 25일까지 제출된 의견을 검토한 후 변경지시(통일조정)를 진행할 예정이다.
조정희 기자
news@pharmstoday.com

