식약처, 임상재평가 결과 허가사항 변경…'휴말겔정' 등 12개 제품
해열·진통·소염제로 사용되는 탈니플루메이트 성분 제제의 일부 효능·효과가 삭제된다.
류마티스관절염과 골관절염(퇴행성관절염) 효능·효과는 유지되지만 외상후 동통, 인두염·편도염·이염·부비동염에 대한 효능·효과는 허가사항에서 삭제된다.식품의약품안전처(처장 류영진)는 탈니플루메이트 성분 제제에 대한 임상재평가 결과, 이 같이 조치했다고 10일 밝혔다.
식약처는 2015년 탈니플루메이트 성분 제제의 '수술 후 염증 및 동통' 등의 효능·효과 입증이 필요하다는 판단아래 임상재평가를 실시했다.이번 조치는 중앙약사심의위원회 자문을 거쳐 최종 결정됐다.
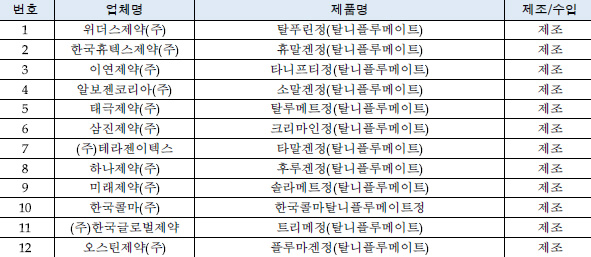
이에 따라 탈니플루메이트 성분 제제의 효능·효과 중 '류마티스관절염, 골관절염(퇴행관절염)'은 허가사항에서 유지되고, '수술 후 염증 및 동통, 외상후 동통 인두염‧편도염·이염·부비동염'은 허가사항에서 삭제된다.허가사항이 변경되는 품목은 한국휴텍스제약의 ‘휴말겐정’ 등 12개이며, 2016년 생산실적은 약 227억원이다.
식약처는 의약전문가, 소비자단체 등에 수술 후 염증 등 입증되지 않은 효능·효과에 대한 처방 및 투약을 중단할 것을 권고하는 내용으로 안전성 서한을 배포했다.입증되지 않은 효능·효과로 처방·조제를 받아 복용 중인 환자의 경우 의약전문가의 상담을 거쳐 대체약으로 처방받거나 반품할 것을 당부했다.
조정희 기자
news@pharmstoday.com

