특허소송 등으로 론칭 방해…브랜드 바이오업체 호재
미국에서 바이오로직 약품의 바이오시밀러 버전의 진입은 느린 것으로 나타났다.
미국 FDA는 대분자 항암제의 2개 카피버전 등 2017년 5개 새로운 바이오시밀러를 승인했다.그러나 법적 장벽 등이 시장 진입을 방해하고 있어 미국에서 실제 출시는 1개에 불과했다.
지난 2년간 승인된 4개 바이오시밀러 중 2개만이 환자들이 이용할 수 있다.FDA가 바이오로직 시장에 더 많은 경쟁을 도입하기 위해 열정적으로 신호를 보내지만 이런 추세는 지속될 것으로 예상된다.
애브비는 미국에서 2023년까지 휴미라(Humira) 바이오시밀러의 출시를 연기하기 위해 암젠과 최근 합의했다.환자들이 이용할 수 있는 3개 바이오시밀러에 대한 경쟁 영향은 상대적으로 적다.
J&J의 레미케이드(Remicade) 바이오시밀러 버전을 판매하는 화이자는 J&J와 보험사 사이에 배타적 계약은 바이오시밀러의 활용을 인위적 방해한다고 주장했다.시장 점유를 위해 2개 바이오시밀러와 경쟁에도 레미케이드의 매출은 3분기 전년동기대비 1.3% 감소에 그쳤다.
이전 미국제네릭의약품협회(GPhA)인 AAM(The Association for Accessible Medicines)에 따르면 바이오시밀러는 향후 10년간 미국 처방약 지출에서 1500억 달러를 절감할 것으로 예상된다.그러나 브랜드 바이오로직 메이커에게 수년간 숨 돌릴 여유를 주는 적용에 장애가 남아 있다.
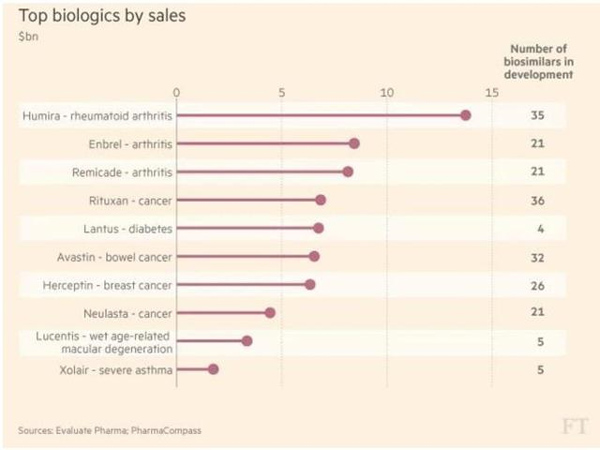
로슈의 항암제 리툭산(Rituxan)의 바이오시밀러는 36개, 아바스틴(Avastin) 32개, 허셉틴(Herceptin) 26개 등이다.
이밖에 엔브렐(Enbrel)과 레미케이드는 각각 21개의 바이오시밀러가 연구 중에 있다.
고재구 기자
news@pharmstoday.com

