올해 FDA 승인 신약 25개 미만…7개 블록버스터 예상
올해 제약 R&D 비용은 블록버스터 수준임에도 불구하고 블록버스터 예상된 약물 수는 급격히 감소한 것으로 파악됐다.
미국 FDA는 올해 신약을 현재까지 21개 승인해 2015년 45개, 2014년 41개의 절반 수준에 불과했다.올해 미국 FDA에서 승인된 신약의 수는 작년의 절반 수준에 그칠 전망이다.
월가의 애널리스트들은 올해 25개 소분자와 바이오로직이 승인될 것으로 추정했다.이는 로슈의 오크레부스(Ocrevus)와 셈프라(Cempra)의 솔리테라(Solithera)가 12월 승인을 가정해 추산했다.
두 약물의 FDA 최종 결정일은 27일과 28일 예정돼 있다.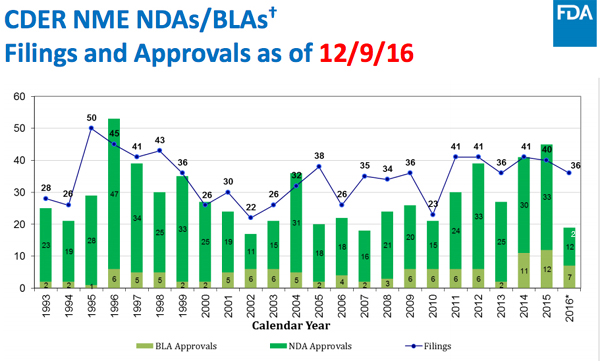
FDA 승인 감소는 최근 수년간 신약 신청 수 감소, 지난 2년에 비해 2016년 FDA 거부 증가 등이 원인으로 지적됐다.
2005~2015년은 평균 28개 신약이 승인됐지만 산업의 유망한 파이프라인을 고려하면 내년에 다시 상승할 수 있다.사노피/리제네론의 류마티스 관절염 치료제 사리루맙(sarilumab) 등 2016년 연기된 일부 제품들이 청신호를 받을 수 있다.
도이치 방크는 2017년 37개 신약이 FDA에서 승인될 것으로 예측했다.약물 연구의 수익성은 지속적인 비용증가와 많은 최신 약물의 높은 비용에 대한 정치적 압력 증가로 하락하고 있다.
블록버스터 신약 적어대다수 제약사들이 역사상 최고 매출 달성을 위해 고군분투하고 있다.
옵디보(Opdivo), 하보니(Harvoni), 이브랑(Ibrance) 등 블록버스터 매출에 도달한 2014년과 2015년의 빛나는 해는 반복되기가 항상 어려울 전망이다.
이벨루에이트파마에 따르면 올해 승인된 티쎈트릭(Tecentriq), 엡클루사(Epclusa), 벤클렉타(Venclexta) 등 7개 신약이 블록버스터 가능성이 있는 것으로 예측된다.컨설팅업체인 글로벌데이터에 따르면 시장에 하나의 신약 론칭 비용은 2016년 약 15.4억달러로 2010년에 비해 30% 증가했다.
한 제품의 출시에 필요한 예상외의 많은 투자에도 불구하고 투자와 회수 사이의 관련은 더 무력하게 증가하고 있고 블록버스터 비용은 블록버스터 매출을 올리지 못하고 있다.
더 차별화된 약물을 생산할 필요성이 급증하고 있어 약물 발견과 개발은 매우 힘들과 위험한 임무이다.
많은 적응증의 복잡한 근본적인 분자생물학은 치료 방법 발견은 종종 실패하고 이런 프로젝트에 투자한 자금은 원하는 회수를 가져오지 못한다.컨설팅업체인 딜로이트(Deloitte)의 보고서를 보면 톱 12개 제약사의 예상된 R&D 투자 회수는 2010년 10.1%에서 올해 3.7%로 떨어졌다.

