사렙타, FDA 첫 마케팅 허가…PTC·산테라 등 바이오텍 연구 주도
최근 사렙타 테라퓨틱스(Sarepta Therapeutics)의 엑손디스51(Exondys 51, eteplirsen)이 미국 FDA에서 마케팅 승인을 받으면서 듀켄씨근위축병(DMD:Duchenne Muscular Dystrophy)에 파이프라인이 주목을 받고 있다.
사렙타는 섬미트 테랴퓨틱스(Summit Therapeutics)의 에주트로미드(ezutromid)의 유럽 권리에 대한 딜을 했다.현재 파이프라인에서 가장 주목받는 업체는 PTC 테라퓨틱스, 산테라(Santhera), 미국 개인기업인 마라톤 파마슈티컬(Marathon Pharmaceuticals)
PTC는 트랜스라나(Translarna)를 유럽에서 조건부 승인을 받았지만 미국에서 거부됐다.회사는 확증적 연구에 대해 최종 합의를 기대했다.
그러나 최근 PTC는 트랜슬라나가 넌센스 변이 듀켄씨근위축병(nmDMD) 치료에 승인을 다시 미국 FDA에서 거부당했다.
산테라의 락손(Raxone)은 유럽에서 승인심사를 받고 있지만 미국에서 신청 계획은 3년까지 신청이 지연될 가능성이 있는 FDA가 글루코코티코이드(glucocorticoid) 치료 환자에 임상 3상 데이터가 필요하다며 연기했다.마라톤은 데플라마코트(deflazacort)를 8월에 FDA에서 우선심사 지정을 받았고 내년에 최종승인이 결정될 것으로 보인다.
데플라자코트는 증상 치료제이지만 196명 환자가 관련된 임상 3상 데이터에서 12주 근력에서 위약군에 비해 유의미한 개선을 보였다.이는 더 일반적으로 사용된 코티코스테로이드와 관련된 체중증가 부작용이 없었다.
특허 불확실은 사렙타에게 걸림돌이다.사렙타는 엑손 스키핑(exon-skipping) 특허에 대한 바이오마린과 특허분쟁을 하고 있다.
사렙타는 엑손 51, 46에 유도된 역배열 올리고핵산염(antisense oligonucleotides)에 대한 바이오마린의 특허가 유효하다는 EU 결정에 항소하고 있다.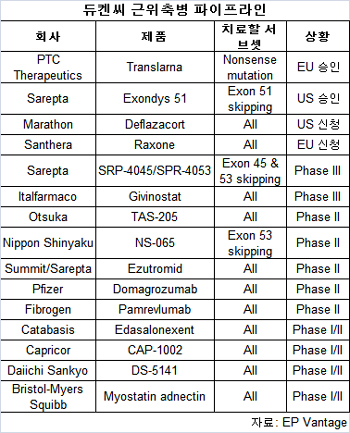
하지만 데이터는 임상 2상에 5개 프로그램과 임상 I/II에 4개 이상을 비교한 중간단계 코호트에서 향후 12개월 이내에 나올 것으로 예상된다.
다음 임상 데이터는 카타바시스의 이다살론익센트(edasalonexent)의 임상 I/II에서 기대된다.이다살론익센트는 NF-kB의 소분자 억제제이다.
사렙타는 엑손 스키핑 분자와 NF-kB 억제제의 미공개 복합에 대한 전임상을 위해 카티바시스와 협력하고 있다.화이자를 제외하고 DMD 파이프라인에 빅 파마의 상대적 부재는 확실하다.
화이자는 도마그로주맙(domagrozumab)의 105명 환자 연구는 이런 적응증에 임상 2상에 있지만 1차 효능 목표로 4계단 오르기의 색다른 측정을 사용하는 반면 보다 일반적인 6분 보행 테스트는 많은 2차 목표 중 하나이다.바이오마린은 DMD에 알려지지 않은 키이다.
회사는 즉시 FDA 거부 킨드리사(Kyndrisa)를 보기 위해 프로센사(Prosensa) 인수에 대규모 투자를 했다.
고재구 기자
news@pharmstoday.com

